Blue Native PAGE凝胶电泳常见问题
Blue Native PAGE凝胶电泳常见问题
1. 在非变性条件下,使用Blue
Native PAGE凝胶进行非变性电泳比使用Tris-甘氨酸凝胶具有哪些优势?
需要使用非离子洗涤剂进行增溶的样品不能兼容传统的非变性Tris-甘氨酸PAGE,因为随着蛋白质在聚丙烯酰胺凝胶中的迁移,会将非离子洗涤剂遗留在条带上方。当缺少非离子洗涤剂时,蛋白质会聚集并在泳道顶部形成垂直线条。当使用蓝色非变性电泳(Blue Native PAGE凝胶)时,Coomassie G-250可显著减少蛋白质的聚集,有效分离膜上的蛋白质复合物,达到Tris-甘氨酸凝胶上得不到的效果。此外,与Tris-甘氨酸系统的工作pH(pH 9.3–9.5)相比,Blue
Native PAGE凝胶较低的工作pH(pH 7.5–7.7)有助于维持碱性pH敏感型蛋白质的非变性结构和/或活性。
2. Blue
Native PAGE凝胶应如何保存?
我们推荐将其保存在4-8℃。不可冷冻。
3. Blue
Native PAGE凝胶的蛋白分离范围是多少?
3-12%RealPAGE Native BN/CN 预制胶可分离分子量在45–10,000 kD范围内的蛋白质。
4-16%RealPAGE Native BN/CN 预制胶可分离分子量在25–10,000 kD范围内的蛋白质。
4. Blue
Native PAGE凝胶的推荐样品上样体积和蛋白质上样量是多少?
我们提供的预制胶是12孔,每个孔的最大上样体积为30 μl,推荐每个泳道的蛋白含量范围在20-50 μg。
5. 我的Blue Native PAGE凝胶在电泳过程中停止电泳了,为什么?该如何继续电泳?
在Blue Native
PAGE凝胶电泳期间,电流下降至低于1 mA很常见。有些电泳电源如伯乐电源有负载检查功能,电流过低(低于4mA) 会认为没有负载,报错E1错误代码,终止电泳。解决方法是更换电泳电源,如使用国产电源;另外可以调高电压高于300 V,使得电流不要低于4mA。

6. Blue Native电泳有配套的蛋白Marker吗?
推荐使用RTD6137 非变性电泳蛋白质Marker(45-880 kD),RTD6142 高分子量非变性电泳蛋白质Marker II(45-669 kD)或者RTD6144 宽分子量非变性电泳蛋白质Marker 21-880 kD。然而由于凝胶浓度较低,低于45 kD条带会压在前沿,可能不可见。
在Blue Native
PAGE电泳中,不能使用预染分子量Marker,因为所有的预染蛋白分子量Marker都是经过变性和还原的,在非变性凝胶上不能良好分离。
请注意,即使使用非变性分子量Marker,在非变性电泳中的分子量预估也是非常不精确的,因为各蛋白质的不同电荷和结构会严重影响凝胶迁移。为获得更精确的预估,可使用质谱分析或排阻层析(SEC)。
7. 你们推荐对Blue Native PAGE凝胶使用哪种染色方法?
Blue Native PAGE凝胶可兼容大多数标准Coomassie
R-250或G-250染料配方。推荐使用FastBlue蛋白染色液(货号:RTD6202)。
8.
5% G-250染料的作用是什么?是否含有洗涤剂?
5% G-250染料(货号BC260)是一种浓缩型Coomassie G-250储液,专为与含有洗涤剂(非离子型)的Blue Native
PAGE凝胶电泳样品一起使用而设计。该染料不含洗涤剂。正常情况下,非变性蛋白在凝胶上的迁移取决于凝胶缓冲液pH下的自然电荷/等电点,但是,加入Coomassie G-250会使蛋白质产生负电荷,即使是通常具有正电荷的高pI蛋白质也能带上负电。该添加剂能够与蛋白质非特异性结合,能够保持蛋白的非变性状态。
9. 你们推荐选择哪种转膜缓冲液用于Blue Native PAGE凝胶转印?
我们推荐选择10×BN转膜缓冲液(货号:BC600P)用于Blue Native PAGE凝胶转印。PVDF是推荐使用的印迹膜,具有良好的转印和检测效果。硝酸纤维素膜(NC膜)不能兼容Blue Native PAGE凝胶转印,这是因为硝酸纤维素膜可与Coomassie
G-250染料发生紧密结合,很难脱离干净。
10. 对于Blue Native PAGE凝胶,你们推荐的转膜条件是什么?
由于Blue Native
PAGE电泳基本关注的是分子量比较大的蛋白或复合体,推荐使用湿转法转膜(货号:RT-ZY01),不推荐用半干转方法转膜。使用BN转膜缓冲液,以下转膜条件仅供参考,客户针对自己的目的蛋白,最好经过1-2次预实验后,确定最佳的转膜条件。
|
蛋白大小
|
稳流
|
建议时间
|
降温措施
|
|
低于70kD
|
150 mA
|
1 小时
|
不需要
|
|
70-300 kD
|
200 mA
|
1.5-2 小时
|
需要
|
|
高于300 kD
|
200 mA
|
2.5-3.5 小时
|
需要
|
11. 凝胶转膜后,我的PVDF膜染上蓝颜色了怎么办?
由于电泳缓冲液和上样缓冲液中含有考马斯亮蓝G-250,凝胶转膜后PVDF膜会有蓝色痕迹,可以把膜浸泡在无水甲醇中漂洗几分钟,去除蓝色。
12. 非变性Marker转到膜上看不到条带,Western Blot检测后我如何判断条带大小呢?
有两种方法可以解决非变性Marker转膜后条带显示问题:
第一种方法:凝胶转膜后用丽春红染色液(货号:RTD6301)染膜,可以看到Marker条带,顺便可以检测转膜效率,然而要注意的是丽春红染色灵敏度比较低,可能不能完全看到完整的Marker条带。
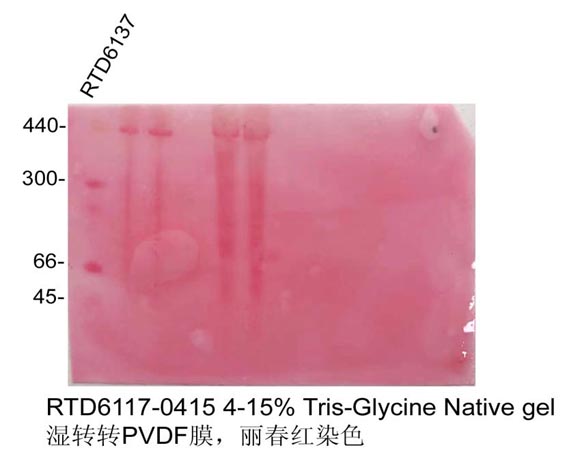
注:北京师范大学惠赠图片
第二种方法(下图):电泳结束后,把含有Marker泳道的凝胶切下,单独用FastBlue蛋白染色液(货号:RTD6202)染色,剩余的凝胶去完成转膜到ECL发光检测过程,最后的发光结果和Marker染色结果拼接判断条带范围。
Jurkat细胞BN电泳 GAPDH检测
电泳:1×蓝色电泳缓冲液(含0.01% G-250)
稳压150V 43分钟;1×无色电泳缓冲液 稳压150V 35分钟
转膜:1×BN转膜缓冲液(不含甲醇),稳流200 mA
(电压72-60V) 1.5小时,未冰浴
膜漂洗去蓝色:PVDF膜无水甲醇浸泡10分钟至膜无色
一抗:GAPDH兔多抗(货号:
RGA1040),1:5000 过夜孵育
二抗:羊抗兔IgG-HRP(货号:
HGR1020) 1:5000 RT 1小时
ECL检测:ECL发光(货号:
EC2520),曝光3.5 min