10×BN转膜缓冲液
|
产品编号
|
产品名称
|
规格
|
|
BC600P
|
10×BN转膜缓冲液(粉末)
|
1升
|
● 简介:
10×BN转膜缓冲液(10×Blue Native Transfer Buffer)适用于BN蛋白电泳后凝胶上非变性蛋白的转膜。本转膜液配制便捷,稀释后无需调节pH值,pH约为7.5-7.7。该缓冲液最终可配成10升即用型1×缓冲液(根据需求补加甲醇)。
● 保存和运输:
粉末装常温保存,常温运输,两年有效;配成10×转膜缓冲液后4℃贮存,一年有效;加入甲醇的即用型转膜缓冲液4℃贮存,一个月有效。
● 配制方法:
将10×转膜缓冲液粉末全部溶解于1升超纯水中,彻底溶解,即配成10×转膜缓冲液。
根据下表配制成1×即用型转膜缓冲液
|
|
1×即用型转膜缓冲液
|
|
|
500 ml
|
1 L
|
2 L
|
|
10×转膜缓冲液
|
50 ml
|
100 ml
|
200 ml
|
|
无水甲醇
|
甲醇终浓度0-20%
|
|
超纯水
|
定容至 500 ml
|
定容至 1升
|
定容至 2升
|
|
|
不要调节pH
|
注:转膜缓冲液中加入甲醇对蛋白有固定作用,转膜分子量较大的蛋白少加或不加甲醇,转膜分子量较小的蛋白要加至多20%的甲醇。非变性蛋白的转膜可以不加甲醇。
● 使用方法:
1. BN电泳介绍:
Blue Native PAGE(BN-PAGE)是一种从生物样品(质膜,胞浆等)中分离分子量10 kD-10 M kD 范围的蛋白质复合物的电泳技术。其原理是用温和去污剂(如 DDM,digitonin)将蛋白复合体从细胞膜中以近似天然的状态分离出来,Blue Native PAGE (BN-PAGE)是用考马斯亮蓝 G-250 代替 SDS与蛋白结合而使其带负电荷,根据蛋白分子量不同在 PAGE胶中得到分离。BN-PAGE由于考马斯亮蓝G-250存在,使蛋白都覆盖上负电荷,可以分离碱性蛋白(pI>7)。BN电泳可以选择Blue/Clear 非变性凝胶电泳试剂盒(U型板3-12%预制胶,通用型)(货号:RTD6139-0312或RTD6139-0416)
2. 电泳后凝胶预处理(可选步骤):
凝胶浸泡于适量1×即用型BN转膜缓冲液(加终浓度0.1% SDS)中,摇床慢摇10分钟。
注:凝胶浸泡在含SDS缓冲液中,能让蛋白带上更多的负电荷,有利于蛋白的转膜。
3. 转膜:
3.1转膜方法:BN电泳后的转膜建议用湿转法。
3.2膜的选择:BN电泳转膜必须使用PVDF膜,不能用NC膜(NC膜会与考马斯亮蓝G-250不可逆结合,很难清除干净)。根据蛋白大小选择膜的孔径。一般说来,大于20 kD蛋白选择0.45 μm孔径,低于20 kD选择0.22 μm孔径。PVDF膜使用前要用无水甲醇润湿活化。
3.3 三明治结构:转膜三明治结构与传统转膜相同,即根据“黑胶白膜”制作三明治,即膜置于转膜夹芯正极一侧,凝胶置于转膜夹芯负极一侧,这样凝胶上带负电荷的蛋白才能转移到膜上。
蛋白转膜三明治制作:
负极(电转夹黑色面)-海绵垫-1层1 mm厚度滤纸-凝胶-膜-1层1 mm厚度滤纸-海绵垫-正
极(电转夹白色面)
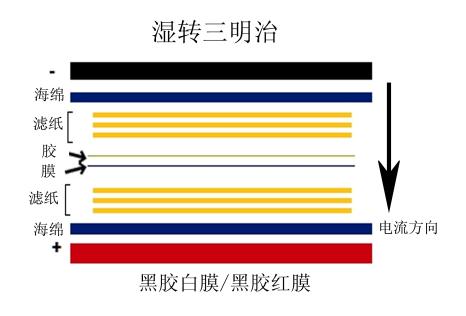
3.4 转膜条件:
由于在非变性条件下,不同蛋白的空间结构,聚合状态,电荷数量都有不同,以下转膜条件仅供参考,客户针对自己的目的蛋白,最好经过1-2次预实验后,确定最佳的转膜条件。
|
蛋白大小
|
稳流
|
建议时间
|
降温措施
|
|
低于70kD
|
150 mA
|
1 小时
|
不需要
|
|
70-300 kD
|
200 mA
|
1.5-2 小时
|
需要
|
|
高于300 kD
|
200 mA
|
2.5-3.5 小时
|
需要
|
4. 洗膜:
PVDF膜用无水甲醇清洗10分钟,彻底去除蓝色G250。
5. 进行后续WB操作:封闭-一抗-二抗-检测。