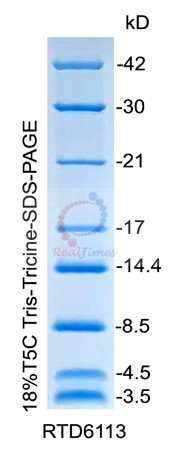
超低分子量蛋白Marker V(3.5-42
kD)(非预染)
Ultra Low Molecular Weight Protein Marker V(3.5-42 kD)
Ver.
750271-2.0
RTD6113 20次(100 μl)
● 贮存、运输及效期:
-20℃保存;湿冰运输;有效期1年。
● 贮存缓冲液成分:
65 mM Tris-HCl (pH 7.0), 20%
Glycerol, 还原剂, 2% SDS, 0.005% 溴酚蓝。
● 产品简介:
本产品包含8种低分子量蛋白质,分子量范围为3.5-42 kD,通过 Tris-Tricine-SDS-PAGE电泳并经考马斯亮蓝染色后可见分子量大小为3.5,4.5,8.5,14.4,17,21,30,42
kD的条带。
以每次上样5 μl计算,该产品可以使用20次。
|
技术规格
|
|
条带数量
|
8条
|
|
浓度
|
0.1-0.3 μg/μl
|
|
上样前处理
|
95-100℃加热处理5
min
|
|
推荐凝胶体系
|
16.5%或18%Tris-Tricine-SDS-PAGE
|
|
推荐上样体积
|
3-5 μl(1mm厚度10齿梳子)
|
|
推荐染色方法
|
非预染Marker,电泳时不可见条带,电泳后需要考马斯亮蓝染色可以观察条带
|
|
不适用于非变性电泳
|
为变性Marker,不适用于非变性电泳
|
● 使用说明:
1. 第一次收到该产品,常温融化后,彻底混匀,离心快甩10
Sec将溶液完全收集到管底,-20℃贮存;
2. 使用该产品时,常温解冻后轻轻混匀或用移液枪缓慢吹打均匀;
3. 从原液中吸取所需的上样量至新的微量离心管中;
4. 95-100°C下加热
5 min,使蛋白质完全变性;
5. 低速离心快甩10 Sec后,取 3-5 μl上样电泳;
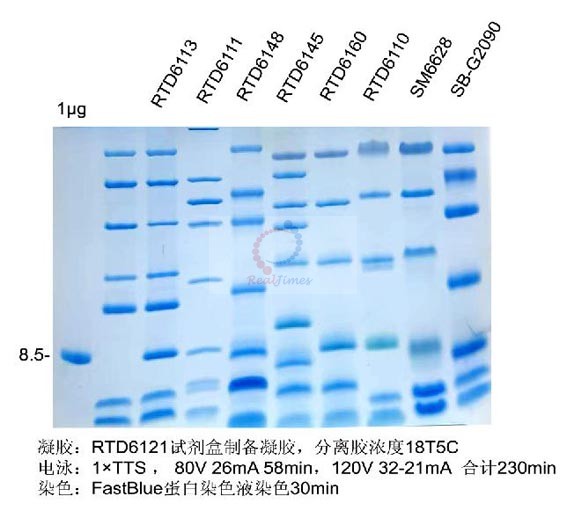
一. 制胶:
多肽电泳建议使用Tris-Tricine-SDS-PAGE系统来分离蛋白,该系统可以分离1-100 kD的蛋白质(最优分离2.5-30 kD)。客户可以使用Tris-Tricine-SDS-PAGE凝胶快速制备及电泳试剂盒
(含预染Marker)(货号:RTD6121)或Tris-Tricine-PAGE凝胶制备及电泳试剂盒(多肽变性电泳)(货号:RTD6122)进行Tricine电泳,方便快捷。或者根据以下程序制备凝胶,先配制分离胶,聚合后再配制夹层胶,最后配制浓缩胶,3种胶的制胶体积比约为4.5:1.5:1.5。
1.1 配制分离胶:
1.1.1 按照表一将不同体积的分离胶组份加入到小烧杯中混合。
表一
(一块1 mm 厚度小板胶用量)
|
|
分离胶
|
夹层胶
|
浓缩胶
|
|
|
16.5%T6%C/4.5
ml
|
10%T3%C/2
ml
|
5%T3%C/2
ml
|
|
49.5%T
3%C
|
/
|
0.4
ml
|
0.2
ml
|
|
49.5%T
6%C
|
1.5
ml
|
/
|
/
|
|
4×凝胶缓冲液
|
1.125
ml
|
0.5
ml
|
0.5
ml
|
|
50%甘油(v/v)
|
0.9
ml
|
-
|
-
|
|
蒸馏水
|
0.95
ml
|
1.1
ml
|
1.3
ml
|
|
10%APS
|
~45
μl
|
~20
μl
|
~20
μl
|
|
TEMED
|
~4.5
μl
|
~2
μl
|
~2
μl
|
注:如非必须,不要使用1.5mm厚度的凝胶,这样会减少电泳后染色和脱色的时间。
1.1.2 加入10%APS和TEMED,立即混匀以使溶液混匀。
1.1.3 在玻璃板中灌入分离胶溶液,然后轻轻覆盖一层1-3 cm的无水乙醇,使凝胶表面保持平整。
1.1.4 静置10-20分钟,待分离胶和乙醇层之间出现一个清晰的界面表示凝胶已聚合。
注:凝胶的聚合时间与环境温度有关。夏天温度较高时,聚合较快;冬天气温低时,聚合时间会延长。分离胶37℃约10分钟,25℃约15分钟,18℃ 约20分钟可以聚合。
1.2 配制夹层胶:
1.2.1 去除覆盖在分离胶上的醇,用滤纸将残留的醇吸去。
1.2.2 按照表一将不同体积的夹层胶组份加入到小烧杯中混合。
1.2.3 加入10%APS和TEMED,立即混匀使溶液混匀。
1.2.4 在玻璃板中灌入适量夹层胶溶液,使液面和短玻璃板上沿之间的距离比梳齿长0.5
cm即可,然后在溶液上轻轻覆盖一层1-3cm的无水乙醇,使凝胶表面保持平整。注:此溶液为过量,请勿全部注入。
1.2.5 静置20-30分钟,待夹层胶和乙醇层之间出现一个清晰的界面表示凝胶已聚合。
注:凝胶的聚合时间与环境温度有关。夏天温度较高时,聚合较快;冬天气温低时,聚合时间会延长。夹层胶37℃ 20分钟,25℃ 25分钟,18℃ 约30分钟可以聚合。
1.3 配制浓缩胶
1.3.1 去除覆盖在夹层胶上的乙醇,用滤纸将残留的醇吸去。
1.3.2 按照表一将不同体积的浓缩胶组份加入到小烧杯中混合。
1.3.3 加入10%APS和TEMED,立即混匀,以使溶液充分混匀。
1.3.4 将梳子插入凝胶内,避免产生气泡。
1.3.5 静置20-40分钟装待凝胶聚合。注:凝胶的聚合时间与环境温度有关。夏天温度较高时,聚合较快;冬天气温低时,聚合时间会延长。浓缩胶37℃ 20分钟,25℃ 30分钟,18℃ 40分钟可以聚合。
二. 电泳:
2.1 电泳缓冲液配制:
电泳前,将10×阳极缓冲液(Cat No:AB080)和10×阴极缓冲液(Cat No:CB010)用蒸馏水稀释成1×缓冲液备用。
2.2 样品处理:
待上样的检测样品与2×Tricine上样缓冲液(Cat:TP050)等体积混合,95℃处理5分钟后上样。蛋白Marker一般已经含有上样缓冲液,预染Marker不能加热处理,混匀后直接上样,非预染Marker一般需要95℃处理5 min后上样。
2.3 电泳:
将电泳槽的外槽加入1×阳极缓冲液,内槽加入1×阴极缓冲液,轻柔拔出梳子,将Marker或蛋白样品加入点样孔,稳压电泳(电泳条件参考下表)
|
|
电压
|
电流变化
|
电泳时间
|
|
浓缩胶
|
恒压30 V
|
起始电流:~ 15 mA
终止电流:~ 10 mA
|
~40
min
|
|
|
|
注:等待样品指示前沿到达夹层胶上沿时,调高电压
|
|
|
夹层胶
|
恒压80 V
|
起始电流:~ 35 mA
终止电流:~ 30 mA
|
~60
min
|
|
|
|
注:等待样品指示前沿到达分离胶上沿时,调高电压
|
|
|
分离胶
|
恒压120 V
|
起始电流:~ 40 mA
终止电流:~ 20 mA
|
~100
min
|
|
待指示前沿到达分离胶下沿时,即可停止电泳,电泳时间总计约200
min。
注:恒压条件下,电流不可调节,电流是逐渐降低的,观察记录电流数值。
|
三. 凝胶检测:
3.1 凝胶染色(FastBlue蛋白染色液):
3.1.1将电泳后的PAGE胶取下放入塑料容器中,用适量蒸馏水漂洗,去除胶表面的SDS,残余SDS会导致染色液出现沉淀。
3.1.2 弃水,加入适量染色液(以刚刚覆盖过胶面为适),摇床上常温摇动,根据下表确定染色时间。
|
待检测蛋白量
|
染色时间
|
|
>1 μg
|
~5分钟
|
|
100 ng-1
μg
|
~10分钟
|
|
10 ng-100
ng
|
~60分钟
|
3. 1.3 摇床上摇动至所有条带清晰可见。
3.
1.4 蒸馏水摇动漂洗脱色1-2次,每次5-10分钟,至凝胶背景干净。
3. 1.5 收集用过的染色液,可以重复使用2-3次。
凝胶也可以使用常规考马斯亮蓝染色液(配方7)和脱色液(配方8)进行染色和观察。需要注意的是,常规染色和脱色方法需要较长时间,小肽由于长度较短,和凝胶结合不紧密,长时间在溶液中浸泡容易从凝胶中脱离。FastBlue蛋白染色液(货号:RTD6202)除具有染色快,无毒,灵敏性高等特点外,还能对小肽在染色中起到固定作用,不至于小肽在染色和脱色中从凝胶中脱离,是常规染色液的理想替代品。
3.2 转膜:
多肽电泳后转膜选择孔径0.22 μm PVDF膜(用前用甲醇处理润湿)或0.22
μm NC膜。
3.2.1
半干转:使用伯乐Trans-Blot Turbo半干转机器请选择配套的5×RealBlot快速半干转转膜缓冲液(货号:RT5030),推荐转膜条件:一板小型凝胶(8×10
cm)恒流,1.3 A,10-15 min。
3.2.1
湿转:湿转转膜缓冲液(25 mM Tris,192 mM Glycine, 0.01%SDS,20%
Methanol,pH~8.3),可以选择10×Tris-甘氨酸转膜缓冲液(货号:TB1040)。推荐转膜条件:恒流200
mA 40-60 min。
四.小分子蛋白质SDS-PAGE电泳试剂配制:
实验示例: