明胶酶谱分析试剂盒
Gelatin Zymography Analysis Kit Ver.710278
|
货号
|
名称
|
规格
|
|
RTD6143
|
明胶酶谱分析试剂盒
|
50次
|
● 产品组成:
|
货号
|
名称
|
规格
|
保存
|
|
RTD6143-01
|
4%浓缩胶聚合溶液A(2×)
|
40 ml
|
4℃
|
|
RTD6143-02
|
4%彩色浓缩胶溶液B(2×)
|
40 ml
|
4℃
|
|
RTD6143-03
|
10%分离胶聚合溶液A(2.5×)
|
100 ml
|
4℃
|
|
RTD6143-04
|
10%分离胶胶溶液B(2×)
|
125 ml
|
4℃
|
|
RTD6143-05
|
10×明胶底物
|
30 ml
|
RT (配制后-20℃)
|
|
RTD6143-06
|
10×复性缓冲液
|
250 ml
|
4℃
|
|
RTD6143-07
|
10×孵育缓冲液
|
500 ml
|
4℃
|
|
RTD6143-08
|
胶原酶阳性对照
|
0.5 ml
|
-20℃
|
|
RTD6202
|
FastBlue蛋白染色液
|
500 ml
|
RT
|
|
PL112
|
5×蛋白上样缓冲液 (变性,非还原)
|
1 ml
|
-20℃
|
|
TG120P
|
5×Tris-甘氨酸-SDS电泳缓冲液(干粉)
|
1 L
|
RT
|
|
AP020P
|
APS(干粉)
|
0.5 g
|
RT (配制后-20℃)
|
|
TA0761
|
TEMED
|
0.5 ml
|
4℃,避光
|
|
|
说明书
|
一份
|
|
● 产品简介:
基质金属蛋白酶(matrix metalloproteinase, MMP)是一种锌依赖性酶,能切割细胞外基质成分,能在一定条件下水解明胶。细胞内的MMP以无活性的酶原形式分泌,活化后能够降解细胞外基质的胶原蛋白,通过影响细胞外基质,参与胚胎发育、形态发生、组织重塑等过程,并参与炎症、肿瘤、心血管、神经等许多疾病过程。血浆与组织中的MMP-2、MMP-9参与各种生理与病理过程,其在临床诊断和治疗中的意义日益受到重视。
本试剂盒采用酶谱法(Zymography)检测MMP-2、MMP-9 活性,其基本原理和程序是:制备含有胶原酶底物明胶的SDS-PAGE 凝胶,含蛋白酶的样品在此凝胶中进行电泳,电泳时,SDS与样本中的MMP可逆性结合,导致MMP氢键和疏水键被破坏而不能发挥分解明胶的作用。电泳结束后取出凝胶与孵育溶液孵育,MMP恢复活性,在其迁移位置水解凝胶中的明胶,考马斯亮蓝染色后凝胶中由于含底物蛋白而被深染,形成深色背景,但在有蛋白酶条带的位置,蛋白酶将降解凝胶中的底物蛋白,因而不被染色而形成透亮白色区域,从而能同时指示MMP-2、MMP-9 的大小位置(酶谱)及活性,其强弱与MMP活性呈正比。
本试剂盒提供明胶酶谱分析的全套试剂,试剂盒可进行50 次标准胶(8×10 cm)检测,如果小胶加样孔为10~15个,则总计可检测500~750 个样品。试剂盒配套有胶原酶阳性对照,可以有效分解明胶,方便判断凝胶及电泳体系是否有问题。
● 贮存及运输:
按照试剂盒标签贮存;常温运输;开封后试剂盒有效期一年。
● 使用说明:
1. 10% APS配制-5 ml:
将0.5 gAPS干粉溶于5 ml灭菌水中,彻底溶解后分装,1 ml/支,-20℃备存,每次取一管使用。10% APS应尽量减少室温存放时间,以防失效。10%APS在4℃有效期为一周,-20℃有效期6个月。若发现凝胶聚合时间延长,应考虑更换使用-20度保存的10%APS。
2. 10×明胶底物配制:
明胶粉末加入30 ml灭菌水,60℃水浴中彻底融化,冷却至常温后使用。明胶底物配制后-20℃贮存。
一 分离胶制备:
1.1参照凝胶模具说明书,装配好凝胶模具。
1.2按照表格将不同体积的成分在小烧杯中混合;最后加入10%APS和TEMED,轻轻搅拌使其混匀,避免产生气泡。
|
|
|
10%分离胶
|
4%浓缩胶
|
|
|
|
5 ml
|
1.6 ml
|
|
加入顺序
|
组份
|
1.0 mm厚度凝胶
|
|
1
|
10%分离胶聚合溶液A(2.5×)
|
2.0
ml
|
-
|
|
2
|
10%分离胶胶溶液B(2×)
|
2.5
ml
|
-
|
|
3
|
10×明胶底物
|
0.5
ml
|
-
|
|
4
|
4%浓缩胶聚合溶液A(2×)
|
-
|
0.8
ml
|
|
5
|
4%彩色浓缩胶溶液B(2×)
|
-
|
0.8
ml
|
|
6
|
10% APS
|
50
μl
|
16
μl
|
|
7
|
TEMED
|
5
μl
|
1.6
μl
|
1.3在凝胶模具中灌入适量分离胶溶液(对于mini-gel,凝胶液加至约距前玻璃板顶端1.5 cm或距梳齿约0.5 cm即可),然后在分离胶溶液上轻轻覆盖一层无水乙醇,使凝胶表面保持平整。
1.4静置5-10分钟,待分离胶和乙醇层之间出现一个清晰的界面后,说明凝胶已聚合
二 浓缩胶制备:
2.1去除覆盖在分离胶上的乙醇层。
2.2按照表格将不同体积成分在一个小烧杯中混合;最后加入10%过硫酸铵和TEMED,轻轻搅拌使其混匀,避免产生气泡。
2.3将浓缩胶溶液加至分离胶的上面,直至凝胶溶液到达前玻璃板的顶端。
2.4将梳子插入凝胶内,避免产生气泡。
2.5静置30-60分钟,等待浓缩胶聚合(25℃
标准凝固时间为50分钟)。
注:凝胶的聚合时间与环境温度有关。夏天温度较高时,聚合较快;冬天气温低时,聚合时间会延长。可以根据表格标准条件调节催化剂的加入量。
三 电泳:
3.1 5×Tris-甘氨酸-SDS电泳缓冲液的配制:
将一包干粉全部倒入1L烧杯中,加入约900 ml水彻底溶解,用水定容至1 L(此溶液不用调节pH值,pH 8.3-8.5)。电泳前将缓冲液稀释5倍即配成1×Tris-甘氨酸-SDS电泳缓冲液。
3.2 样品处理:融化-混合-上样
3.2.1 将5×蛋白上样缓冲液(变性,非还原)常温融化后混匀。
3.2.2 将上样缓冲液与蛋白样品按照1:4的比例混匀。
注:由于MMP活性需要二价阳离子,蛋白样品中避免使用EDTA、EGTA等二价阳离子鳌和剂以及巯基乙醇和DTT等。
蛋白样品提取可以选择RL0120F RIPA裂解液(强,不含抑制剂,不含螯合剂)
3.2.3 快甩离心收集到管底,常温放置5-10分钟,不要加热处理样品,上样电泳。
胶原酶阳性对照同时上样5-10 μl。
3.3 电泳:
在电泳槽的内槽加入1×电泳缓冲液,轻轻拨出梳子,冲洗加样孔,随后在电泳槽外槽加入适量的1×电泳缓冲液。上样,恒电压150 V电泳。
电泳条件(一板胶)
|
恒电压
|
起始电流
|
终止电流
|
电泳时间
|
可选
|
|
150V
|
30-40mA
|
8-15mA
|
50 min+
|
冰浴电泳
|
四 MMP检测:
4.1 漂洗:
取出凝胶,放入容器内,加入50 ml蒸馏水漂洗凝胶,摇床慢摇5分钟,重复一次。
4.2 复性:
4.2.1
1×复性缓冲液配制:
将10×复性缓冲液用蒸馏水稀释10倍,如10 ml 10×复性缓冲液加90 ml蒸馏水。
注:如10×复性缓冲液由于低温贮存有析出时,37℃彻底溶化后再使用。
4.2.2 复性:
取出凝胶,弃蒸馏水,加入50 ml 1×复性缓冲液,摇床慢摇30分钟。
注:复性结束后,凝胶呈乳白半透明状。
4.3 孵育:
4.3.1 1×孵育缓冲液配制:
将10×孵育缓冲液用蒸馏水稀释10倍,如10 ml 10×孵育缓冲液加90 ml蒸馏水。
4.3.2 孵育:
倒掉1×复性缓冲液,加入50 ml 1×孵育缓冲,37℃
摇床慢摇10分钟;
弃1×孵育缓冲液,加入 50 ml 1×孵育缓冲,37℃ 摇床慢摇4小时-过夜孵育。
注:阳性对照-胶原酶IV通常37℃孵育3-4小时即可消化凝胶中的明胶。如样品中MMP 活性低,应延长孵育时间至过夜。
4.4 显色:
4.4.1 漂洗:倒掉孵育液,凝胶中加入50 ml蒸馏水,摇床慢摇5分钟,重复一次。
4.4.2 弃蒸馏水,加入50 ml FastBlue染色液(以刚刚覆盖过胶面为适),摇床上常温摇动30分钟-2小时,凝胶大部分区域被深染,在有MMP 条带的位置不被染色而形成透亮区域;蒸馏水漂洗2-3次,每次5-10分钟。
4.5 拍照:
由于考马斯亮蓝染色,凝胶背景为蓝色,自然光下拍照效果不好。建议使用凝胶观察透射灯(货号:RT3820)底部打光拍照。
五 实验示例:
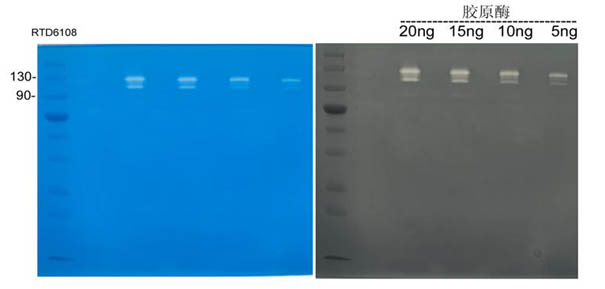
10%分离胶(含明胶底物)
电泳条件:1×TGS
150V 36-12mA 90 min
实验步骤:
漂洗:蒸馏水漂洗两次;
复性:50 ml 1×复性缓冲液常温复性30分钟;
孵育:50
ml 1×孵育缓冲液37度孵育10分钟;
50
ml 1×孵育缓冲液37度孵育15小时;
漂洗:蒸馏水漂洗两次;
染色:FastBlue染色60分钟。
实验结果:胶原酶消化明胶底物,在70-130 kD区间产生明亮条带。
明胶酶谱分析试剂盒(10篇)
使用该产品发表部分文章列表:
1. [2021 IF=3.5] Salidroside
protects against ventilation-induced lung injury by inhibiting the expression
of matrix metalloproteinase-9.
Author: Hui
Zhang, Wenwen Dong, Siyuan Li, Yunqian Zhang, Zhou Lv, Lu Yang, Lai Jiang, Tao
Wu & Yan Wang.
Journal: Pharmaceutical
Biology. 2021, VOL. 59, NO. 1, 760–768
Institution: Xinhua
Hospital, Shanghai Jiaotong University School of Medicine
Paper link:https://doi.org/10.1080/13880209.2021.1967409
2. [2021 IF=2.73] Synovial
mesenchymal stem cell-derived extracellular vesicles alleviate chondrocyte
damage during osteoarthritis through microRNA-130b-3p-mediated inhibition of
the LRP12/AKT/β-catenin axis.
Author: Zhenhua
Zeng, Yi Dai, Shuo Deng, Sanbao Zou, Tingyang Dou & Feng Wei.
Journal: Immunopharmacology
and Immunotoxicology. Published in 2022
Institution: Department
of Pain, the First People's Hospital of Jiashan County, Jiaxing
Paper link:https://www.tandfonline.com/doi/full/10.1080/08923973.2022.2038192
3. [2021 IF=4.5] CXCL13
as a Novel Immune Checkpoint for Regulatory B Cells and Its Role in Tumor
Metastasis.
Author: Jun
Ren, Tianxia Lan, Ting Liu, Yu Liu, Bin Shao, Ke Men, Yu Ma, Xiao Liang,Yu-quan
Wei, Min Luo, and Xia-wei Wei
Journal: The Journal
of Immunology Published April 18, 2022
Institution: West China Second Hospital, Sichuan
University
Paper link: http://www.jimmunol.org/cgi/doi/10.4049/jimmunol.2100341
4. [2021 IF=5.075] Protective
Effects of Epigallocatechin-3-gallate (EGCG) against the Jelly?sh Nemopilema
nomurai Envenoming.
Author: Jie Li, Qianqian Wang, Shuaijun Zou, Juxingsi Song, Peipei
Zhang, Fan Wang, Yichao Huang , Qian He , and Liming Zhang
Journal: Toxins 2023, 15, 283
Institution: Naval Medical University
Paper link:https://doi.org/10.3390/toxins15040283
5. [2021 IF=4.1] ADAMDEC1 induces
EMT and promotes colorectal cancer cells metastasis
by enhancing Wnt/β-catenin signaling via negative modulation of
GSK-3β.
Author: Yuna Jia, Xiaoyong Huang, Haiyan Shi, MingMing Wang, Jie Chen,
Huahua Zhang, Danyang Hou , Hongmei Jing, Juan Du, Huihui Han, Jing Zhang
Journal: Experimental Cell Research 429 (2023) 113629
Institution:Department of Obstetrics, Affiliated
Hospital of Yan’an University
Paper link: https://doi.org/10.1016/j.yexcr.2023.113629
6. [2021 IF=8.0] Extracellular
Vesicles Maintain Blood-Brain Barrier Integrity by the Suppression of Caveolin-1/CD147/VEGFR2/MMP
Pathway After Ischemic Stroke.
Author: Yiyang Li, Jiali Chen, Xingping Quan, Ying Chen, Yan Han, Jinfen
Chen, Li Yang, Youhua Xu, Xu Shen, Ruibing Wang, Yonghua Zhao
Journal: International Journal of Nanomedicine 2024:19 1451–1467
Institution:University of Macau
Paper link: https://pubmed.ncbi.nlm.nih.gov/38371456/
7. [2022 IF=9.7] Direct contact
between tumor cells and platelets initiates a FAK-dependent F3/TGF-β positive
feedback loop that promotes tumor progression and EMT in osteosarcoma.
Author: Qianyu Shi, Jiuhui Xu, Chenglong Chen, Xueyu Hu, Boyang Wang,
Fanwei Zeng, Tingting Ren , Yi Huang, Wei Guo, Xiaodong Tang, Tao Ji
Journal: Cancer Letters 591 (2024) 216902
Institution:Department of Musculoskeletal Tumor,
Peking University People’s Hospital
Paper link: https://doi.org/10.1016/j.canlet.2024.216902
8. [2022 IF=4.6] Crocin’s role in
modulating MMP2/TIMP1 and mitigating hypoxia?induced pulmonary hypertension in mice.
Author: Jing Deng, Rui?Qi Wei, Wen?Mei Zhang,
Chang?Yu Shi, Rui Yang, Ming Jin,Chunmei Piao
Journal: Scientifc Reports (2024) 14:12716
Institution:Beijing Anzhen Hospital Afliated to the
Capital Medical University
Paper link: https://doi.org/10.1038/s41598-024-62900-8
9. [2023 IF=20.5] Gut–liver translocation of
pathogen Klebsiella pneumoniae promotes hepatocellular carcinoma in mice
Author: Xueliang Wang, Yi Fang, Wei
Liang, Yuhong Cai, Chi Chun Wong, Junlin Wang, Na Wang
, Harry Cheuk-Hay Lau , Ying Jiao, Xingyu Zhou, Liufang Ye,
Mengmiao Mo, Tao Yang, Miao Fan, Lei Song, Heming Zhou , Qiang Zhao, Eagle Siu-Hong Chu,
Meinong Liang, Weixin Liu, Xin Liu, Shuaiyin Zhang, Haitao Shang, Hong Wei,
Xiaoxing Li, Lixia Xu, Bing Liao, Joseph J. Y. Sung, Ming Kuang,Jun Yu.
Journal: Nature Microbiology,Volume 10,January 2025,169–184
Institution:Shenzhen Research Institute, The Chinese
University of Hong Kong, Hong Kong
Paper link: https://www.nature.com/articles/s41564-024-01890-9
10. [2023 IF=5.2] Functional study of Bergeyella
cardium KP-43 subfamily peptidases as putative T9SS cargo.
Author: Tian Li, Yiwen Gao, Xiaoyue Zhang, Yuxiao Zhao,FuyaoHu,WeiLi, Lixiang Li,Hongwei
Pan,YiZhang, Ying Chen
Journal: Communications Biology (2025)8:586
Institution:Qilu Hospital of Shandong University
Paper link: https://doi.org/10.1038/s42003-025-07996-y