6%Tris-醋酸-SDS-PAGE电泳试剂盒(变性电泳,手灌胶)
|
货号
|
名称
|
规格
|
|
RTD6162
|
6%Tris-醋酸-SDS-PAGE电泳试剂盒(变性电泳,手灌胶)
|
10次
|
● 产品组成:
|
货号
|
名称
|
规格
|
贮存
|
|
RTD6162-UA
|
上层胶溶液A
|
15
ml
|
4℃
|
|
RTD6162-UB
|
彩色上层胶溶液B
|
15
ml
|
4℃
|
|
RTD6162-LA06
|
下层胶溶液A 6%
|
30
ml
|
4℃
|
|
RTD6162-LB
|
下层胶溶液B
|
30
ml
|
4℃
|
|
TA1510
|
400×抗氧化剂
|
15
ml
|
4℃
(配制后-20℃贮存)
|
|
TA050
|
10×Tris-醋酸-SDS电泳缓冲液(变性电泳,溶液型)
|
500
ml
|
RT
|
|
PL080-01
|
5×MonoClolor蛋白上样缓冲液 (变性,还原)
|
1 ml
|
-20℃
|
|
RTD6202-02
|
FastBlue蛋白快速染色液
|
500 ml
|
RT
|
|
TA5030P
|
10×Tris-醋酸转膜缓冲液(湿转,粉末型)
|
500
ml
|
RT
|
|
AP020P
|
10%
APS(干粉)
|
5
ml
|
RT
(配制后-20℃贮存)
|
|
TA0761-01
|
TEMED
|
0.5
ml
|
4℃ 避光
|
|
|
说明书
|
一份
|
-
|
● 产品简介:
Tris-醋酸-SDS-PAGE凝胶电泳适合于分离高分子量蛋白,可以有效分离50-500 kD范围内蛋白;电泳体系呈中性,能有效提高蛋白的稳定性;电泳缓冲体系中加入抗氧化剂,整个电泳过程都在还原条件下进行,有效防止二硫键的形成。
该试剂盒包含凝胶制备、蛋白上样、蛋白电泳、蛋白染色及转膜所需的全部试剂。试剂盒配套的制胶溶液,可以配制10板厚度1mm凝胶(面积8×10 cm),分离胶浓度为6%,可以有效分离50-500 kD范围内蛋白。配好的凝胶浓缩胶为红色,方便上样。本试剂盒用于蛋白变性还原电泳,不适用于蛋白非变性电泳。
按照一次实验电泳一板凝胶计算,本试剂盒可以使用10次。
● 贮存、运输及效期:
按照标签温度贮存;试剂盒常温运输;有效期一年。
● 使用说明:
一. 实验准备:
1.1 10%APS为干粉,用前加入5 ml超纯水震荡彻底溶解,适量分装后取一管使用。溶解后的APS -20℃贮存。
1.2 400×抗氧化剂为干粉,用前加入15 ml超纯水震荡彻底溶解后使用,已经溶解的400×抗氧化剂-20℃贮存。
二. 凝胶配制:
2.1参照凝胶模具说明书,装配好凝胶模具。
2.2 根据下表配制凝胶:
|
下层胶配方
|
上层胶配方
|
|
胶厚度
|
下层胶溶液B
|
下层胶溶液A
|
10%APS
|
TEMED
|
胶厚度
|
彩色上层胶溶液B
|
上层胶溶液A
|
10%APS
|
TEMED
|
|
0.75 mm
|
2 ml
|
2 ml
|
40 μl
|
4 μl
|
0.75 mm
|
0.5 ml
|
0.5 ml
|
10 μl
|
1 μl
|
|
1.0 mm
|
2.5 ml
|
2.5 ml
|
50 μl
|
5 μl
|
1.0 mm
|
0.75 ml
|
0.75 ml
|
15 μl
|
1.5 μl
|
|
1.5 mm
|
4 ml
|
4 ml
|
80 μl
|
8 μl
|
1.5 mm
|
1 ml
|
1 ml
|
20 μl
|
2 μl
|
2.2.1 取等体积下层胶溶液B 和下层胶溶液A ,各
2.0/2.5/4.0 ml,混匀;
2.2.2混合溶液中加入 40/50/80 μl的10%APS和4/5/8
μl的TEMED,轻轻混匀,将混匀后的溶液注入制胶玻璃板中,使液面和短玻璃板上沿之间的距离比梳齿长0.5 cm即可;
注意:此溶液为过量,请勿全部注入。
2.2.3 沿玻璃板缓慢加入适量灭菌水或无水乙醇覆盖于下层胶之上,待下层胶凝固后,倒去上层水或乙醇;
注意:当水(乙醇)和胶之间有一条折射线时,说明胶已凝固;25℃时10-15分钟可以聚合。
2.2.4 取等体积彩色上层胶溶液B和上层胶溶液A ,各
0.5/0.75/1.0 ml,混匀;
2.2.5向混合溶液中加入 10/15/20 μl 的10%APS和1/1.5/2
μl 的TEMED,轻轻混匀,插入梳齿;
2.2.6 待上层胶凝固后 (约20-40
min),拔去梳齿即可用于电泳。
注:凝胶的聚合时间与环境温度有关。夏天温度较高时,聚合较快;冬天气温低时,聚合时间会延长。
上层胶25℃ 20-25分钟可以聚合;18℃ 35-40分钟可以聚合。
三. 电泳:
3.1 准备1×电泳缓冲液:
|
总体积
|
1000
ml
|
|
10×Tris-醋酸-SDS电泳缓冲液
|
100 ml
|
|
超纯水
|
900 ml
|
3.1.1 外槽缓冲液:取适量体积1×电泳缓冲液用于外槽缓冲液。
3.1.2 内槽缓冲液:200 ml 1×电泳缓冲液中加0.5 ml 400×抗氧化剂,混合均匀后用于内槽缓冲液。
3.2准备上样样品:
注:表格以配制10 μl样品为例,其他体积按照比例调整。
|
|
总体积10 μl
|
|
组份
|
还原样品
|
|
蛋白样品
|
x μl
|
|
5×MonoClolor蛋白上样缓冲液 (变性,还原)
|
2 μl
|
|
超纯水
|
补至10 μl
|
|
|
95℃ 10分钟
|
3.3电泳过程;
在电泳槽的内槽加入内槽缓冲液(已加入抗氧化剂),让电泳缓冲液漫过加样孔,轻轻的拨出梳子,用1ml吸头冲洗加样孔3次;随后在电泳槽外槽加入适量的外槽缓冲液(不用添加抗氧化剂)。上样,电泳。
|
恒电压
|
起始电流
|
结束电流
|
电泳时间
|
|
200
V
|
65-75 mA/板胶
|
35-55 mA/板胶
|
50+min
|
|
注:冰浴电泳(可选)
|
四. 染色:
注:如果只是观察蛋白的分离情况,对凝胶进行染色。如果要后续进行WB实验,凝胶不要染色,进行步骤五。
4.1 将电泳后的PAGE胶取下放入塑料容器中,加入适量FastBlue蛋白染色液(以刚刚覆盖过胶面为适),摇床常温摇动,条带5-10分钟即可见(蛋白含量高于1
μg条带)。
4.2 摇床常温继续摇动15-30分钟至条带清晰可见。
4.3 加入适量蒸馏水脱色,期间更换1-2次蒸馏水,摇床常温摇动10-15分钟至背景干净。
4.4 观察保存结果。
五. 转膜:
5.1 转印膜选择:
Tris-醋酸凝胶转膜可以使用NC膜和PVDF膜,需要选择0.45 μm孔径。PVDF膜使用前注意需要用甲醇润湿活化。
5.2 10×Tris-醋酸转膜缓冲液(溶液型)配制:
将10×Tris-醋酸转膜缓冲液(湿转,粉末型)粉末溶解于500 ml超纯水中,即配成500 ml 10×Tris-醋酸转膜缓冲液(溶液型),不要调节pH,pH~7.2。
5.3 准备1×转膜缓冲液:
|
|
|
1×即用型转膜缓冲液 配制量 1升
|
|
|
10×Tris-醋酸转膜缓冲液(溶液型)
|
100
ml
|
|
20-80 kD蛋白
|
无水甲醇
|
10%
|
|
SDS
|
0.05%
|
|
>80 kD蛋白
|
无水甲醇
|
10%(NC膜)
0-5%(PVDF膜)
|
|
SDS
|
0.1%
|
|
|
超纯水
|
定容至1升,不要调节pH,pH~7.2
|
注:甲醇和SDS在转膜中有拮抗作用。甲醇使蛋白更加结合在膜上,而SDS让蛋白更加离开膜。因此对大蛋白转膜来说,多加SDS,少加甲醇;而对小蛋白转膜,多加甲醇,少加SDS。
5.4 转膜条件:
高分子量蛋白建议湿转。以下转膜条件仅供参考,客户针对自己的目的蛋白,最好经过1-2次预实验后,确定最佳的转膜条件。
|
膜孔径
|
蛋白大小
|
稳流
|
建议时间
|
降温措施
|
|
0.45 μm
|
50-200 kD
|
350 mA
|
~60分钟
|
需要
|
|
0.45 μm
|
高于200
kD
|
350 mA
|
~2-3小时
|
需要
|
六. 实验示例:
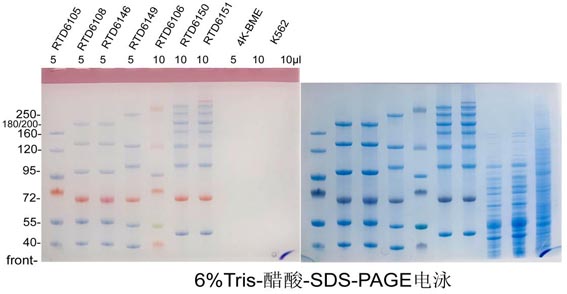
凝胶:6%Tris醋酸手灌胶
电泳:1×TAS 200V 70-42mA 55min;内槽加抗氧化剂
染色:FastBlue蛋白染色液染色 15 分钟
样品:4K-BME-细菌裂解物;K562-悬浮细胞RIPA提取总蛋白