动物线粒体提取试剂盒(细胞样品)
(Animal Cell Mitochondria Isolation
Kit)
|
产品货号
|
名称
|
规格
|
|
RTD8115
|
动物细胞线粒体提取试剂盒(细胞样品)
|
50次
|
● 产品简介
动物细胞线粒体提取试剂盒(Animal
Cell Mitochondria Isolation Kit)可以快速便捷分离培养细胞的线粒体。试剂盒的缓冲系统不含任何表面活性剂和螯合剂EDTA,分离获得的线粒体纯度较高,并且绝大部分分离获得的线粒体都含有完整的内膜和外膜,可以用于线粒体的生理功能等方面的研究。另外,优化的裂解配方配套离心柱法有效裂解细胞,省去了经典方法使用玻璃匀浆器的繁琐操作,更加省时省力。同时,本试剂盒在分离线粒体的同时可以获得去除线粒体的细胞胞浆蛋白,可以研究线粒体蛋白向胞浆内的运输机制。
该产品约30分钟即可完成培养细胞线粒体的提取。线粒体是在温和、非变性条件下提取的,结合不同的溶解液,溶解后的线粒体可以用于SDS-PAGE变性电泳检测、Blue
Native非变性电泳检测以及等电聚焦电泳等。另外,提取的线粒体具有生理功能,可以用于线粒体的生理功能等方面的研究。
按照每次提取2×107细胞计算,试剂盒可以使用大约50次。
● 产品组成
|
产品编号
|
名称
|
规格
|
贮存
|
|
RTD8115-01
|
分离缓冲液A
|
15 ml
|
-20℃
|
|
RTD8115-02
|
分离缓冲液B
|
15 ml
|
-20℃
|
|
RTD8115-03
|
漂洗缓冲液
|
30 ml
|
-20℃
|
|
RTD8115-04
|
贮存缓冲液
|
3 ml
|
-20℃
|
|
PS1020
|
变性蛋白溶解液
|
5 ml
|
RT
|
|
CD-50
|
离心柱套装
(包含离心柱和2ml连盖收集管)
|
50个
|
RT
|
|
|
|
|
|
|
|
说明书
|
|
|
● 贮存条件和运输:
按照标签温度贮存;有效期一年;湿冰运输。
● 用前必读:
1. 离心机请调整成RCF/g模式,按照离心力设置离心机(不要根据转速rpm模式设置),所有离心步骤都需要在4℃低温离心机中进行。
2. 将分离缓冲液A,分离缓冲液B,漂洗缓冲液和贮存缓冲液混匀后放置于冰上。将离心柱套入2 ml连盖收集管中,盖好管盖,放置于冰上预冷。
3. 蛋白提取推荐添加蛋白酶抑制剂(自备,试剂盒不提供),根据蛋白酶抑制剂母液浓度提前添加在膜蛋白提取溶液中(如抑制剂母液是 100×,添加时按照1:100添加,即1ml膜蛋白提取溶液添加10μl抑制剂)。研究蛋白磷酸化,需要添加磷酸酶抑制剂(自备,试剂盒不提供)。
4.
蛋白定量推荐使用BCA方法,可以选择BCA蛋白浓度测定试剂盒(货号:RTP7102)。
● 使用方法:
一. 准备溶液:
常温溶解试剂盒中的各种溶液,溶解后立即置于冰上并混匀。如果最终实验目的是制备线粒体蛋白样品,根据样品数量,取适量体积分离缓冲液A加入蛋白酶抑制剂。按照下表大体估算分离缓冲液A的使用体积:
|
细胞类型
|
培养器皿
|
细胞数量
|
细胞沉淀体积(PCV)(μl)
|
分离缓冲液A(μl)
|
|
悬浮细胞
|
|
~2×107
|
~200
|
250
|
|
贴壁细胞
|
96孔板
|
~1×105
|
调整细胞数目到2×107
|
250
|
|
24孔板
|
~5×105
|
|
6孔板
|
~2.5×106
|
|
25cm2培养瓶
|
~2×106
|
|
75cm2培养瓶
|
~8×106
|
|
35
mm培养皿
|
~2×106
|
|
60
mm培养皿
|
~5×106
|
|
100
mm培养皿
|
~1.5×107
|
注:(二百万,2×106)HeLa细胞,其细胞沉淀体积(PCV,Packed Cell Volume)大约为20 μl。
二. 收集细胞:
2.1
对于贴壁细胞:细胞用PBS漂洗一遍,弃PBS;再加入适量PBS,用细胞刮刀刮下细胞,或用0.02%
EDTA(0.5
mM)溶液处理细胞使细胞不再贴壁很紧,并用移液器吹打下细胞。400
g(~2000
rpm)
4℃离心5
min收集细胞,尽最大努力吸尽上清,留下细胞沉淀备用。尽量避免用胰酶消化细胞,以免胰酶降解需提取的目的蛋白。
2.2
对于悬浮细胞:400
g(~2000
rpm)4℃离心5
min收集细胞,用PBS洗一遍,离心收集细胞,尽最大努力吸尽上清,留下细胞沉淀备用。
三. 裂解细胞膜:
3.1细胞沉淀中加入250
μl准备好的分离缓冲液A(含蛋白酶抑制剂),用移液器吹打重悬细胞沉淀,涡旋剧烈震荡30-60秒,冰浴处理10分钟,间歇2-3混匀。
注:建议将起始细胞数不要低于2×107,否则将导致最后线粒体得率过低。
3.2
将细胞悬液转移到离心柱中,盖上管盖,16,000
g(~13000
rpm) 4℃离心1分钟,离心后收集管底部会有沉淀形成。
注:离心柱最大体积为600 μl;确保离心机可以在10秒内达到16000 g。
3.3 弃去离心柱,盖好2
ml收集管管盖,用1ml移液器轻柔吹打重悬收集管中的沉淀。
四. 去除细胞核和未破碎的细胞:
溶液700 g(~2700 rpm)
4℃离心1分钟,用200
μl吸头小心将上清(上清稍有浑浊)转移到新的1.5
ml离心管中。注意:转速不要超过700g,否则会降低线粒体的得率。
关键步骤:吸取上清时不要触及沉淀,甚至可以丢弃部分上清不吸取,以免上清(含线粒体)中污染核蛋白。如果使用250 μl分离缓冲液A,建议吸取200 μl上清。此步骤得到的细胞核纯度不高,混杂有没有完全破碎的完整细胞,不建议用于相关实验。
五. 收集线粒体:
5.1
上清中加入等体积的分离缓冲液B(如步骤4吸取200
μl上清,则加入200
μl分离缓冲液B),混匀;
5.2
16000 g(~13000
rpm)
4℃离心10分钟,用200
μl吸头吸去上清,沉淀即为提取的线粒体。上清是胞浆蛋白,如需要可保存备用。
关键步骤:此步骤必须完全将上清吸取干净,可以用200μl吸头分次吸取上清,最后用10 μl吸头将残余上清彻底吸净,以免线粒体中污染胞浆蛋白。
六. 线粒体漂洗:
线粒体沉淀中加入0.5 ml 漂洗缓冲液,轻柔重悬沉淀,16,000 g,4℃离心5分钟,弃上清,沉淀即为漂洗后的线粒体。
七. 线粒体的使用:
7.1 线粒体功能研究:
如果用于完整线粒体的功能或酶活性研究,初始2×107细胞分离得到的线粒体样品中加入100-150
μl线粒体贮存缓冲液,重悬线粒体后-80℃备用。不建议长期贮存,尽快使用。
7.2 线粒体蛋白电泳:
7.2.1线粒体蛋白变性样品处理:
7.2.1.1 初始2×107细胞分离得到的线粒体沉淀中建议使用50
μl变性蛋白溶解液(货号:PS1020)溶解线粒体沉淀;
7.2.1.2
BCA方法测定蛋白浓度(货号:RTP7102);
7.2.1.3用变性蛋白溶解液调整蛋白浓度为1
μg/μl,按需分装,每管50
μl,-80℃保存待用;
7.2.1.4取一管50
μl样品加入SDS-PAGE上样缓冲液(货号:PL080,PL113,PL121)处理,建议调整上样液浓度为0.5
μg/μl;对于多次跨膜蛋白(Multi-pass
membrane protein)的变性电泳检测,样品建议使用37℃处理30分钟,不要95℃加热5分钟,因为在95℃高温情况下,多次跨膜蛋白极易聚集形成多聚体,样品会聚集,WB检测会表现为比实际蛋白大小更大的分子量;
7.2.1.5
使用SDS-PAGE凝胶(货号:RTD6132,RTD6116)电泳,每个泳道上样10-40
μl(5-20
μg)。
7.2.2 线粒体蛋白BN非变性样品处理:
7.2.2.1 初始2×107细胞分离得到的线粒体沉淀中建议使用50
μl膜蛋白重悬液(BN电泳用)(货号:PN1020)重悬线粒体沉淀;
7.2.2.2
BCA方法测定蛋白浓度(货号:RTP7102);
7.2.2.3 用膜蛋白重悬液(BN电泳用)(货号:PN1020)调整蛋白浓度为1
μg/μl,按需分装,每管50
μl,-80℃保存待用;
7.2.2.4
取一管50
μl样品,溶化混匀后4℃
16000 g 5分钟,去除上清,保留沉淀;
7.2.2.5 沉淀中加入50
μl膜蛋白增溶液A(货号:DM1080),轻柔重悬沉淀,尽量不产生气泡,冰浴10分钟;
7.2.2.6 4℃
16000 g 15分钟,取上清至一干净1.5 ml离心管中即为增溶后线粒体蛋白溶液(小心不要吸取沉淀),此时得到的线粒体蛋白浓度为1
μg/μl,其中去垢剂DDM(n-Dodecyl
β-D-maltoside,β-DM, n-十二烷基-β-D-麦芽糖苷)终浓度为1%;
7.2.2.7 线粒体蛋白溶液中加入1/10体积10×膜蛋白A型上样缓冲液(配套膜蛋白增溶液A使用)(货号:PL130),使用BN凝胶电泳(货号:RTD6139,RTD6140),每个泳道上样5-20
μg。
7.2.3 线粒体蛋白等电聚焦样品处理(2D凝胶第一维电泳):
建议线粒体沉淀中使用溶解液:7
M尿素,2
M硫脲,
2%CHAPS,20 mM DTT(自备,试剂盒不提供)。
八 线粒体产量和质量的评价:
8.1 线粒体产量:
|
细胞系
|
细胞数量
|
线粒体蛋白
|
|
K562
|
2×107
|
100-150 μg
|
|
Jurkat
|
2×107
|
80-100 μg
|
|
Hela
|
2×107
|
100-150 μg
|
|
NIH-3T3
|
2×107
|
80-120 μg
|
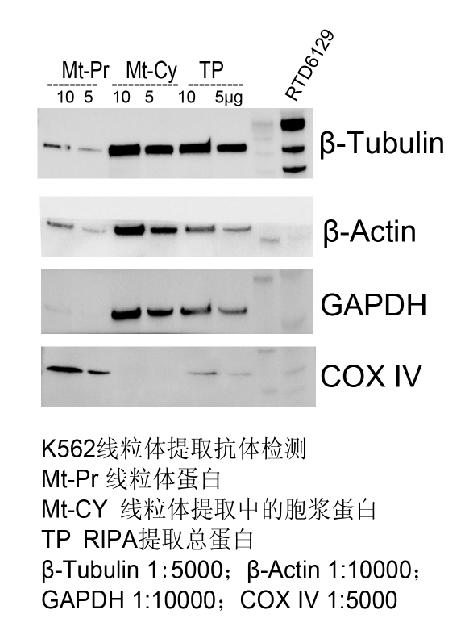
8.2 线粒体质量评价:
线粒体质量评价首先看提取的线粒体是否具有完整的内外膜结构(进行线粒体功能活性研究),其次要看裂解后的线粒体蛋白是否有明显的富集,其三要看裂解后的线粒体蛋白是否有其他组分交叉污染,最后看提取的线粒体中是否可以检测出目的蛋白。使用专门的线粒体内参检测(下表),可以初步确认提出的是线粒体蛋白。线粒体蛋白是否有效富集需要用总蛋白作为对照,与总蛋白相比,线粒体内参蛋白是否有明显富集。线粒体蛋白中的交叉污染可以用其他组分内参检测线粒体蛋白样品,如关注线粒体蛋白中是否有胞浆蛋白污染,可以使用胞浆蛋白内参检测线粒体蛋白,检测条带的强弱即说明线粒体蛋白与胞浆蛋白交叉污染的程度。用目标蛋白抗体检测线粒体蛋白,验证是否可以检测到目的蛋白,蛋白大小是否符合预期。
|
位置
|
内参名称
|
大小 kD
|
|
细胞膜
|
Na-K ATPase
|
100
|
|
内质网膜
|
Calnexin
|
~90
|
|
线粒体膜
|
COX IV
|
17
|
许多研究人员利用
WB对分离的线粒体蛋白进行纯度检测,经常发现一些常用的胞浆内参能在线粒体蛋白中检测到,例如β-actin[1],
GAPDH [2] 和 β-tubulin,这是由于这些胞浆内参不仅存在于胞浆也存在于线粒体中,因此可以在线粒体蛋白中检测到胞浆内参。更多信息,请参阅以下论文:
1
Hatch, Anna L., Pinar S. Gurel, and Henry N. Higgs. Novel roles for actin in
mitochondrial fission. Journal of Cell Science (2014) 127,
1–12
2
Zhang, Jin-Ying, et al. Critical
protein GAPDH and its regulatory mechanisms in cancer cells. Cancer
Biol Med 2015;12:10-22.
九 实验示例:
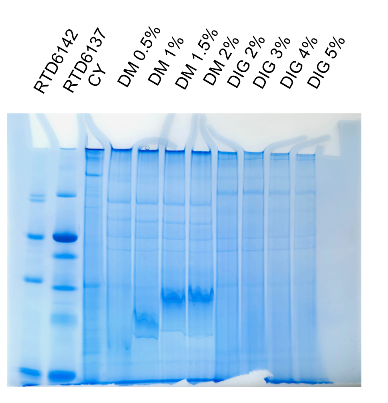
不同去垢剂处理K562细胞线粒体3-12%BN电泳