动物核蛋白与胞浆蛋白提取试剂盒(细胞样品)
Animal Nuclear and
Cytoplasmic Protein Extraction Kit for Cells
|
产品货号
|
名称
|
规格
|
|
RTD8301
|
动物核蛋白与胞浆蛋白提取试剂盒(细胞样品)
|
50 次
|
● 产品简介:
在研究细胞时经常要研究细胞的不同组份,而研究得最多的两个细胞组份就是细胞核和细胞浆。分离核蛋白和胞浆蛋白,不仅可以用于研究蛋白在细胞内的定位,而且可以用于转录调控方面的研究,例如EMSA(也称gel
shift),footprinting等。动物核蛋白与胞浆蛋白提取试剂盒(Animal
Nuclear and Cytoplasmic Protein Extraction Kit)提供了一种比较简单方便地从培养细胞中抽提细胞核蛋白与胞浆蛋白的方法。约90分钟就可以完成培养细胞的细胞核蛋白与细胞浆蛋白的分离。抽提得到的蛋白可以用于Western,EMSA,footprinting,报告基因检测以及酶活力测定等实验。
本试剂盒是通过细胞核提取缓冲液在低渗透压条件下,使细胞充分膨胀,破坏细胞膜,释放出细胞浆蛋白,然后通过离心得到完整的细胞核(细胞核可以重悬于细胞核贮存缓冲液中
-80℃贮存);细胞核用核蛋白提取试剂I裂解,配合核酸酶Benzonase消化掉核酸,离心得到变性核蛋白;或者使用核蛋白提取试剂II裂解,离心得到非变性(活性)核蛋白。一般情况下,胞浆蛋白与核蛋白之间的交叉污染低于10%。
对于细胞样品,如果每个样品的数量5×106-1×107,本试剂盒可以抽提50个样品。
● 产品组成:
|
产品编号
|
名称
|
规格
|
贮存
|
|
RTD8301-01
|
细胞裂解缓冲液A
|
45 ml
|
-20℃
|
|
RTD8301-02
|
细胞裂解缓冲液B
|
1 ml
|
4 ℃
|
|
RTD8301-03
|
细胞核贮存缓冲液
|
0.5 ml
|
-20℃
|
|
RTD8301-04
|
核蛋白提取试剂I(变性)
|
5 ml
|
-20℃
|
|
RTD8301-05
|
核蛋白提取试剂II(非变性)
|
5 ml
|
-20℃
|
|
RTD8301-06
|
台盼蓝染色液
|
0.5 ml
|
4℃
|
|
PM1790S-01
|
PMSF溶液(100 mM)
|
1 ml
|
-20℃
|
|
RTT2106-01
|
Benzonase(250 U/μl)
|
50 μl
|
-20℃
|
|
DT0140P-01
|
1 M DTT
|
1 ml
|
4℃(配制后-20℃)
|
● 贮存条件和运输:
根据标签温度贮存;有效期一年;试剂盒湿冰运输。
● 用前必读:
1. 离心机请调整成RCF/g模式,按照离心力设置离心机(不要根据转速rpm模式设置),所有离心步骤都需要在4℃低温离心机中进行。
2. 蛋白提取推荐添加蛋白酶抑制剂,根据蛋白酶抑制剂母液浓度提前添加在蛋白提取溶液中(如抑制剂母液是 100×,添加时按照1:100添加)。研究蛋白磷酸化,需要添加磷酸酶抑制剂(自备,试剂盒不提供)。
3. 蛋白定量推荐使用BCA方法,可以选择BCA蛋白浓度测定试剂盒(货号:RTP7102)。
● 使用方法:
一 胞浆蛋白和核蛋白的提取:
1.
1准备溶液:常温溶解试剂盒中的试剂,溶解后立即放置在冰上,混匀。取适当量的细胞裂解缓冲液A,在使用前加入PMSF溶液和/或磷酸酶抑制剂(自备,试剂盒不提供)和1/1000体积的1
M DTT,随后立即放于冰上待用。
|
组份
|
一次提取需要体积
|
PMSF溶液
|
1
M DTT
|
Benzonase
|
|
细胞裂解缓冲液A
(步骤1.4.1和1.5.1)
|
800 μl
|
8 μl
|
0.8 μl
|
-
|
|
核蛋白提取试剂I(变性)
(步骤1.6.1.2)
|
100 μl
|
1 μl
|
0.1 μl
|
1 μl
|
|
核蛋白提取试剂II(非变性)(步骤1.6.2.2)
|
50 μl
|
0.5 μl
|
-
|
-
|
1.2
准备细胞:
1.2.1
对于贴壁细胞:用PBS漂洗一遍,弃PBS;再加入适量PBS,用细胞刮刀刮下细胞,或用0.02%
EDTA(0.5
mM)溶液处理细胞使细胞不再贴壁很紧,并用移液器吹打下细胞。450
g 4℃离心5
min收集细胞,尽最大努力吸尽上清,留下细胞沉淀备用。尽量避免用胰酶消化细胞,以免胰酶降解需抽提的目的蛋白。
1.2.2
对于悬浮细胞:450
g 4℃离心5
min收集细胞,用PBS洗一遍,离心收集细胞,尽最大努力吸尽上清,留下细胞沉淀备用。
1.3 按照下表大体估算提取溶液使用体积:
|
细胞类型
|
培养器皿
|
细胞数量
|
细胞沉淀体积(PCV)(μl)
|
细胞裂解缓冲液A(μl)
|
|
悬浮细胞
|
|
5-10×106
|
>50
|
400
|
|
贴壁细胞
|
96孔板
|
~1×105
|
调整细胞数目到5-10×106
|
|
24孔板
|
~5×105
|
调整细胞数目到5-10×106
|
|
6孔板
|
~2.5×106
|
调整细胞数目到5-10×106
|
|
25cm2培养瓶
|
~2×106
|
调整细胞数目到5-10×106
|
|
75cm2培养瓶
|
~8×106
|
~80
|
|
35
mm培养皿
|
~2×106
|
调整细胞数目到5-10×106
|
|
60
mm培养皿
|
~5×106
|
~50
|
|
100
mm培养皿
|
~1.5×107
|
调整细胞数目到5-10×106
|
注:(二百万,2×106)HeLa细胞,其细胞沉淀体积(PCV,Packed Cell Volume)大约为20 μl。
1.4
胞浆蛋白提取:
1.4.1细胞沉淀中加入准备好的400
μl细胞裂解缓冲液A(含抑制剂和DTT),用1 ml吸头吹打重悬细胞沉淀5-10次,把细胞沉淀完全悬浮并分散开,冰浴5分钟。
1.4.2
加入20
μl 细胞裂解缓冲液B(按照细胞裂解缓冲液A体积的1/20加入),混匀,冰浴5-10分钟。
注1:此步骤尽量不要漩涡震荡沉淀,否则得到的细胞浆蛋白可能会污染核蛋白。
注2:裂解缓冲液对不同细胞的裂解能力有不同,敏感细胞裂解5分钟足够,其他细胞冰浴时间不要超过10分钟。
1.4.3
4℃ 16000g 离心5分钟,取80%上清即为胞浆蛋白,保存备用。
注:吸取上清时千万不要触及沉淀,可以只取80%体积上清,以免胞浆蛋白中污染细胞核。每5-10×106细胞用400
μl细胞裂解缓冲液A裂解后获得的上清,其细胞浆蛋白浓度约为1-2 μg/μl,不同细胞略有不同。
1.5
收集细胞核:
1.5.1
彻底去除步骤1.4.3离心管内上清,沉淀中再次加入400
μl细胞裂解缓冲液A(含PMSF和DTT),用1 ml吸头吹打重悬沉淀至沉淀完全散开(注:涡旋震荡不易悬浮沉淀),冰浴5分钟。
注:此步骤目的是彻底漂洗沉淀中残余的未裂解细胞,可以大大提高细胞核的纯度
1.5.2
4℃ 16000g 离心5-10分钟,彻底去除上清,沉淀即为完整的细胞核。
注:尽量完全把上清去除干净,否则细胞核中会污染胞浆蛋白。
1.5.3
细胞核沉淀中加入50
μl细胞核贮存缓冲液,用吸头完全重悬沉淀,得到细胞核溶液。该溶液可以-80℃贮存。
1.5.4 可选步骤:取10 μl细胞核溶液,加入10 μl台盼蓝染色液,混匀后,常温放置2分钟,显微镜下观察细胞核的染色情况,提取良好的细胞核为均一蓝色,没有粘连(如图)。

1.6 细胞核蛋白提取:
1.6.1 变性核蛋白提取:
注:此步骤使用含有SDS的提取试剂B,完全裂解核膜,释放出细胞核内容物,提取的是完全变性的核蛋白,适用于SDS-PAGE电泳Western
Blot检测。
1.6.1.1
取一管50
μl细胞核溶液,4℃
16000g 离心2分钟,去除上清,保留沉淀。
1.6.1.2
沉淀中加入100
μl核蛋白提取试剂I(变性)(含PMSF和DTT)和1
μl Benzonase,吸头重悬沉淀,37℃处理30分钟至几乎无可见不溶物。
注:加入核蛋白提取试剂I(变性)后,细胞核裂解释放出大量核酸,溶液非常粘稠,核酸酶Benzonase可以消化掉核酸,降低粘度。
1.6.1.3
4℃16,000g离心10分钟,立即吸取上清至一预冷的离心管中,即为抽提得到的变性核蛋白。可以立即使用,也可以-80℃冻存。每5-10×106细胞用100微升提取试剂B裂解后获得的上清,可以使用BCA蛋白浓度测定试剂盒(货号:RTP7102)测定浓度,其核蛋白浓度约为1-3
μg/μl,不同细胞略有不同。
1.6.2 非变性核蛋白提取:
注:此步骤使用高盐缓冲液使得细胞核收缩,核酸结合蛋白(如转录因子)与核酸分离,扩散到细胞核外部,离心后上清中为非变性(活性)核蛋白,适用EMSA,转录因子活性分析等实验。
1.6.2.1
取一管50
μl细胞核溶液,4℃
16000g 离心2分钟,去除上清,保留沉淀。
1.6.2.2
沉淀中加入50
μl核蛋白提取试剂II(非变性)(含PMSF,不要添加DTT),吸头重悬沉淀,4℃旋转混匀30
min,至最后得到的溶液无可见悬浮物。
注:如不能旋转混匀,可以冰浴30 min,每隔5分钟混匀一次。
1.6.2.3
4℃16,000g离心10分钟,立即吸取上清至一预冷的离心管中,即为抽提得到的活性核蛋白。可以立即使用,也可以-80℃冻存。每5-10×106细胞用50微升核蛋白提取试剂II(非变性)裂解后获得的上清,可以使用BCA蛋白浓度测定试剂盒(货号:RTP7102)测定浓度,其细胞核蛋白浓度约为1-3
μg/μl,不同细胞略有不同。
二 关于胞浆蛋白和核蛋白产量和质量的评价:
2.1蛋白产量:
|
细胞系
|
细胞数量
|
胞浆蛋白
|
核蛋白
|
|
K562
|
1×107
|
~0.8 mg
|
~0.2 mg
|
|
HEK293
|
4×107
|
~9.4 mg
|
~0.55 mg
|
|
Jurkat
|
1.5×107
|
~2.6 mg
|
~0.23 mg
|
|
Hela
|
5.4×106
|
~1.9 mg
|
~0.34 mg
|
|
NIH-3T3
|
7.9×106
|
~1.9 mg
|
~0.28 mg
|
2.2 胞浆蛋白和核蛋白质量评价:
蛋白分区提取的质量评价首先看提取的蛋白是否是分区蛋白,其次要看分区蛋白是否有明显的富集,其三要看提出的分区蛋白是否有其他组分交叉污染,最后看提取的分区蛋白中是否可以检测出目的蛋白。使用专门的胞浆内参和细胞核检测(下表),可以初步确认提出的是胞浆蛋白还是核蛋白。蛋白是否有效富集需要用总蛋白作为对照,与总蛋白相比,胞浆蛋白内参或核内参是否有明显富集。交叉污染可以用其他组分内参检测蛋白样品,如关注胞浆蛋白中是否有细胞核蛋白污染,可以使用核蛋白内参如Lamin
B1检测胞浆蛋白,检测无条带即说明胞浆蛋白与细胞核组分无交叉污染。用目标蛋白抗体检测分区蛋白,验证是否可以检测到目的蛋白,蛋白大小是否符合预期。
|
位置
|
内参名称
|
大小 kD
|
|
|
胞浆蛋白内参
|
GAPDH
|
37
|
|
|
β-Actin
|
45
|
|
|
β-Tubulin
|
55
|
推荐
|
|
核内参
|
Histone H3
|
17
|
存在于线粒体中,胞浆中可以检测到
|
|
PCNA
|
36
|
|
|
Lamin B1
|
68
|
推荐
|
三 实验示例:
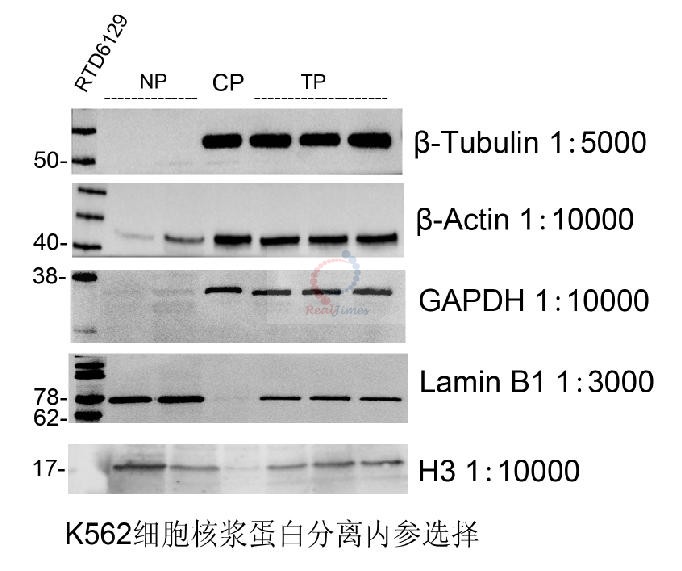
Jurkat总蛋白,细胞浆蛋白,细胞核蛋白GAPDH检测
总蛋白提取:4×106 K562细胞,400 g 离心收集,去上清,沉淀中加入200
μl RIPA(加2 μl 100 mM PMSF),冰上裂解5分钟,4℃
16000 g 15 分钟,上清即为总蛋白(TP)。
细胞浆蛋白:4×106 K562细胞,400 g 离心收集,加入400
μl细胞裂解缓冲液A (加4
μl 100mM PMSF,加0.4 μl 1 M DTT),悬浮沉淀,冰浴5分钟;加入20
μl细胞裂解缓冲液B,混匀,冰上孵育5分钟,4℃
16000g 5分钟,小心收集上清即为细胞浆蛋白(CP),不要触及沉淀。
细胞核蛋白提取:沉淀中计入100
μl核蛋白提取试剂I(变性),1
μl Benzonase,37℃ 30 min,4
℃ 16000 g 10分钟,上清即为细胞核蛋白(NP)。
电泳:RTD6117-0420 200V 33-12 mA 55 min
转膜:NC膜,1×RealBlot快速转膜液湿转,稳流400
mA,电压变化64-57 V,转膜时间35
min
封闭:无蛋白快速封闭液RT 10 min
一抗孵育;二抗孵育;检测:ECL发光检测