RealPure Animal Tissues/Cell RNA Extraction Kit
RealPure动物组织/细胞RNA提取试剂盒
● 试剂盒内容及保存:
|
试剂盒组成
|
RTR2306-01 (50次)
|
贮存方式
|
|
裂解液RL
|
30
ml
|
常温
|
|
去蛋白液RD
|
30
ml
|
常温
|
|
漂洗液RW(浓缩液)
|
25
ml
首次使用按照标签加入无水乙醇
|
常温
|
|
RNase-free水
|
5
ml
|
4℃
|
|
DNA清除柱CS(RNase-free)
|
50个
|
常温
|
|
RNA吸附柱CR(RNase-free)
|
50个
|
常温
|
|
收集管
|
100个
|
常温
|
|
2
ml离心管(RNase-free)
|
50个
|
常温
|
|
1.5
ml离心管(RNase-free)
|
150个
|
常温
|
|
说明书
|
1份
|
|
● 储存条件和效期:
RNase-free水4℃贮存;其他试剂在常温(25℃左右)干燥条件下,可保存1年。试剂盒常温运输。
● 产品简介:
本试剂盒可从动物组织中快速提取总RNA,
可同时处理大量不同样品。提取的总RNA纯度高,没有蛋白和其它杂质的污染,可用于RT-PCR、Real
Time RT-PCR、芯片分析、Northern Blot、Dot
Blot、PolyA 筛选、体外翻译、RNase
保护分析和分子克隆等多种下游实验。
● 准备工作:
1操作前在裂解液RL中加入β-巯基乙醇至终浓度1%,如1
ml RL中加入10 μl β-巯基乙醇。此裂解液最好现用现配。配好的
RL4 ℃可放置3天。
2
按照标签所示在漂洗液RW中加入无水乙醇(自备),混匀后盖紧瓶盖后常温贮存备用。
3
所有离心步骤均在常温下进行。
● 操作步骤:
1. 样品处理和裂解:
1.1 贴壁细胞:
1.1.1直接裂解法:
不需胰酶消化,彻底吸干净培养液体后直接加推荐量裂解液 RL(使用前请先检查是否已加入β-巯基乙醇)(下表)反复吹打细胞裂解,可以漩涡震荡,直到看不到细胞团为止,进行步骤2。
|
培养器皿
|
底面积(cm2)
|
加培养液量 ml
|
可获细胞量
|
裂解液RL加入体积
|
|
24孔培养板
|
2
|
1
|
5×106
|
350 μl
|
|
3.5cm培养皿
|
8
|
3
|
2×106
|
350 μl
|
|
6孔培养板
|
9.6
|
2.5
|
2.5×106
|
600 μl
|
|
6cm培养皿
|
21
|
5
|
5.2×106
|
600 μl
|
|
25cm培养皿
|
25
|
5
|
5.2×106
|
600 μl
|
|
100ml玻璃培养瓶
|
33
|
10
|
7×106
|
600 μl
|
1.1. 2 胰蛋白酶消化法:
确定细胞数量(收集细胞数量请不要超过1×107),吸除培养基,用PBS洗涤细胞,吸除PBS,向细胞中加入胰酶消化液处理细胞,当细胞脱离容器壁时,加入含有血清的培养基失活胰蛋白酶,将细胞溶液转移至1.5 ml离心管中,300×g离心5
min,收集细胞沉淀,仔细吸除所有上清,加 350 μl(<5x106细胞)或 600 μl(5x106-1x107细胞)裂解液 RL(使用前请先检查是否已加入β-巯基乙醇),反复吹打细胞裂解,可以漩涡震荡,直到看不到细胞团为止,进行步骤2。
1.2 悬浮细胞:
300×g离心 5 min收集悬浮细胞(收集细胞数量请不要超过1×107)到一个1.5ml 离心管中,完全吸弃上清,加 350 μl(<5x106细胞)或 600 μl(5x106-1x107细胞)裂解液 RL(使用前请先检查是否已加入β-巯基乙醇),反复吹打细胞裂解,可以漩涡震荡,直到看不到细胞团为止,进行步骤2。
1.3 动物组织:
新鲜组织加入350
μl(<20mg 组织)或者
600 μl(20-30mg 组织)的裂解液RL(使用前请先检查是否已加入β-巯基乙醇)后玻璃匀浆器或电动匀浆器将组织彻底研磨匀浆,进行步骤2。
注意:组织量一定不要超过30 mg,否则将导致RNA得率和质量下降。
背景知识:样品处理量绝对不要超过DNA/RNA吸附柱处理能力,否则造成DNA/RNA残留或者产量降低。不同组织细胞种类DNA/RNA相差极大,例如胸腺脾脏DNA含量丰富,超过5 mg就会超过柱子处理能力。COS细胞RNA含量丰富,超过3x106细胞就会超过柱子吸附能力。所以开始摸索实验条件时,如果不清楚样品DNA/RNA含量时宁可使用较少的样品处理量,如细胞不超过3-4x106,组织不超过10mg,随后根据实验结果增加或者减少处理量。
2. 离心得到上清:
若没有不溶性沉淀,直接进行步骤3。如有不能裂解的碎片或者不溶物,13,000
rpm离心5 min, 取裂解物上清进行下一步。
3. 去除基因组污染和洗脱RNA:
将DNA清除柱CS放入一干净的2 ml离心管内,用移液器小心将步骤1离心管内的溶液或步骤2离心后的上清全部转移到DNA清除柱CS中,13,000
rpm离心2分钟(RNA在离心管滤液中,不要丢弃)。
注:确保全部溶液都收集到2 ml离心管中,如果膜上有残留液体,延长离心时间至5分钟,保证膜上无残留液体。
4. RNA挂柱:
向2 ml离心管滤液中加入0.5倍体积的无水乙醇(如滤液体积为300 μl/600 μl,加入150
μl/300 μl无水乙醇),此时可能会出现沉淀,立即混匀,不要离心。将全部溶液加入到RNA吸附柱CR中(吸附柱放入收集管中),13,000 rpm离心1分钟。
注:确保溶液全部过滤到收集管中,膜上无残留,如有必要,可以延长离心时间至5分钟。
5. 去除RNA中的蛋白污染:
向RNA吸附柱CR中(吸附柱放入收集管中)加入500 μl 去蛋白液RD,13,000
rpm离心1分钟,弃废液。
6. 去除RNA中的其他杂质:
向RNA吸附柱CR中加入700
μl漂洗液RW(使用前请先检查是否已加入乙醇), 13,000 rpm离心1分钟,弃废液。
7. 进一步去除RNA中的其他杂质:
向吸附柱CR中加入500
μl漂洗液RW (使用前请先检查是否已加入乙醇),13,000 rpm离心1
分钟,弃废液。
8. 关键步骤:彻底去除吸附柱上的残余乙醇:
将吸附柱CR放回收集管中,确保盖好吸附柱管盖,13,000 rpm将吸附柱CR空甩离心2 分钟,去除吸附柱上的残余液体。
注:此步骤目的是将吸附柱中残余漂洗液去除,如果有漂洗液残留,可能会影响后续的RT等实验操作。
9. 洗脱得到RNA:
将RNA吸附柱CR转入一个新的1.5 ml RNase-free离心管中,向吸附柱O型垫圈中央悬空加入50-100 μl RNase-free水(事先65℃预热可提高洗脱效率),盖好吸附柱管盖,常温放置2分钟,13,000
rpm离心2 分钟。
注:确保水要加到膜的中央,不要贴壁加入;洗脱缓冲液体积不应少于50 μl,体积过小影响回收效率。
10. RNA贮存:
RNA样品-80℃中保存。
● RNA产量和质量的评估:
1. RNA产量:
用分光光度计测定OD260的吸光值来计算RNA产量。将RNA按照一定的比例稀释于TE溶液(10mMTris pH8.0,1mMEDTA)中,根据以下公式计算:
A260×稀释倍数×40=μg
RNA/ml
注:测定OD值时,尽量不要用RNase-free水稀释RNA,因为RNase-free水pH较低,测定的OD值偏低。
2. RNA质量:
凝胶电泳检测:凝胶电泳中,动物的完整RNA应该有两条主带:28S和18S,并且28S亮度应该与18S相当或是其亮度的2倍。可以使用普通的1×TAE琼脂糖凝胶电泳,凝胶浓度1-1.5
%,可以使用高电压,短时间电泳,如7V/cm电泳,20分钟。建
议使用D2000
DNA ladder(Cat:RTM415)作为Marker。28S
rRNA迁移率与1800bp类似,18S
rRNA迁移率与700bp类似。
吸光值检测:可以用A230,A260和A280的数值表示RNA的纯度。纯净的RNA的
A260/A280比值应该为2,我们得到的RNA样品比值应在1.8-2.2之间,如果比值低于1.8,表明RNA样品中蛋白污染比较严重。A260/A230比值应该在2-2.2之间。如果此比值低于2,表明RNA样品中有胍盐的污染。
● 实验示例:
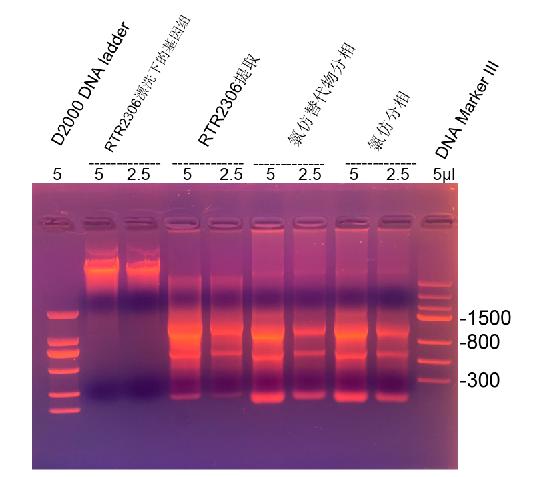
1.2%琼脂糖胶 1×TAE 150V 25min
RealSafe Red预染
RNA提取试剂提取步骤:K562悬浮细胞,1 ml收集(6×106/ml),PBS漂洗两遍,加入1 ml RNA提取试剂,悬浮后常温静置10分钟,加入氯仿或氯仿替代物200 μl,彻底混匀后静置10分钟,自然分相,4度 13000 rpm 离心15分钟,上清中加入等体积异丙醇,常温静置20分钟,4度 13000 rpm离心15分钟,沉淀用1 ml 75%乙醇漂洗,4度 8000rpm 离心2分钟,沉淀溶于50μl
RNase-free水中。
RTR2306操作简述如下:K562悬浮细胞,1ml收集(6×106/ml),PBS漂洗两遍(平行做2管)。沉淀中加入350 μl 裂解液RL(已加β-ME),常温裂解5分钟,裂解物加到DNA清除柱CS中,离心收集到2 ml离心管中,离心管中加入0.5倍体积无水乙醇,全部溶液加到RNA吸附柱CR中,离心,随后清除柱CS和RNA吸附柱CR一次RD漂洗,2次RW漂洗,最后每个吸附柱用50 μl
RNase-free水洗脱,合并两管得到100 μl RNA和100 μl去除的基因组DNA。
● 问题指南:
1. 离心柱发生堵塞
离心柱发生堵塞之后会造成 RNA 得率降低甚至不能纯化得到 RNA。
常见原因分析如下:
1.1组织或细胞破碎不彻底。
破碎不彻底会使吸附柱发生堵塞,同时会影响 RNA 得率及质量。我们建议在进行裂解时,尽量借助辅助手段如机械匀浆彻底破碎组织。
1.2 样本初始量过多。
样本使用量过多会导致裂解液RL裂解细胞时不完全,导致离心柱堵塞。该试剂盒处理样本的初
始最大量107细胞或30 mg组织。
1.3 离心机的温度过低。
整个 RNA 分离纯化所有的步骤均在常温(20-25℃)进行。有些低温离心机的温度低于 20℃,可能会造成离心柱的堵塞。如果发生这种现象,请将离心机温度设置到
20-25℃。
2. 提取不到RNA或者RNA产量低
通常会有多种因素影响回收效率,比如:样本 RNA 含量、操作方法、洗脱体积等。
常见原因分析:
2.1 样本保存不当或样本保存时间过久导致RNA 已经降解。
建议:新采集的样本应立即放入液氮中速冻,长期保存于-70℃并避免样本的反复冻融;或者将样本立即浸泡在 RNA 稳定剂RNAwait溶液中。
2.2 样本破碎裂解不充分导致纯化柱堵塞。
建议:参见1。
2.3 洗脱液添加不正确。
建议:确认 RNase-Free 水滴加到了纯化柱膜O型垫圈中央位置。
2.4 漂洗液RW中没有添加正确体积的无水乙醇。
建议:请按照说明书,在试剂盒使用前,漂洗液RW中添加正确体积的无水乙醇并混匀。
2.5 组织样本用量不合适。
建议:每 600 μl 裂解液RL使用最大细胞量为1×107,使用最大组织量为30
mg,过多会导致
RNA 提取量降低并且得到的
RNA 纯度也会降低。我们强烈建议每单次
RNA提取操作,样本初始用量一定不要超过最大建议量。
2.6 洗脱体积不合适或洗脱不彻底。
建议:纯化柱的洗脱液体积为 50-100 μl;若洗脱效果并不理想,建议在加入65℃预热的RNase-Free 水后,延长常温放置的时间,例如放置
5-10 min。
2.7 纯化柱在第二次RW洗涤之后有乙醇残留。
建议:漂洗液RW洗涤后,吸附柱空甩离心2 min是关键步骤,以充分除去吸附柱上残留的乙醇。
3. 纯化获得的RNA有降解
纯化得到的 RNA 的质量和样本的保存、RNase 污染、操作等因素有关。
常见原因分析:
3.1 组织样本采集后没有及时保存。
建议:组织样本在收集后若不及时使用,请立即低温保存于液氮中或经液氮速冻后立即转移至-70℃
长期保存,或者将样本立即浸泡在 RNA 稳定剂 RNAwait溶液中。提取 RNA 请尽量使用新近采取的组织样本。
3.2 组织样本反复冻融。
建议:组织样本保存时,最好分装成小份,使用时取出其中一份即可,避免样本的反复冻融导致 RNA 的降解。
3.3 操作间有 RNase 引入或没有佩戴一次性手套、口罩等。
建议:RNA 提取实验最好在单独的 RNA 操作间进行,并在实验前清理好实验桌,实验时佩戴一次性手套、口罩,最大程度上避免
RNase 引入导致的RNA
降解。
3.4 试剂在使用过程中被 RNase 污染。
建议:更换新的提取试剂盒进行相关实验。
3.5 RNA 操作时所用的离心管、枪头等有 RNase 污染。
建议:确认 RNA 提取时所用到的离心管、枪头、移液器等都是 RNase-Free。
4. RNA中含有DNA污染
4.1 提取的起始材料量超过最大建议量
建议:步骤1-样品处理时使用107细胞或30
mg组织,不要超过最大处理量,否则样品的核酸量会超过DNA清除柱CS的处理极限,导致洗脱下的RNA有基因组DNA的污染。
4.2 省略了步骤3-去除基因组污染步骤。
建议:步骤3-去除基因组污染步骤必不可少,不能省略。DNA清除柱CS能极大限度的去除上清液中的基因组
DNA,使用裂解液RL洗脱下的RNA基本无基因组DNA的污染。
4.3 跳过了使用去蛋白液RD的漂洗步骤(见操作步骤第5步)。
建议:这一步骤对于除去残留的 DNA 以及杂质蛋白十分重要,一定不能省略,否则将会导致纯化得到的
RNA 中含有DNA
污染和蛋白污染。
5. 纯化获得的RNA影响下游实验
经吸附柱纯化的 RNA,如果盐离子、蛋白质含量过多会影响下游实验,比如:逆转录、Northern
Blot 等。
1. 洗脱后的 RNA 有盐离子残留。
建议:确认漂洗液RW中添加了正确体积的乙醇,并按操作说明的离心转速进行2次RW洗涤吸附柱 (见操作步骤第6,7步)。
2. 洗脱后的 RNA 有乙醇残留。
建议:确认 RW第二次洗涤后,按操作说明的对吸附柱进行空管离心操作(见操作步骤第8 步),如果还有乙醇残留,可以将空管离心后吸附柱开盖常温放置 5 min,以最大程度上去除