RealPure®Plant Seed RNA Extraction Kit
RealPure®植物种子RNA提取试剂盒
● 试剂盒内容及保存:
|
试剂盒组成
|
RTR2308-01 (50次)
|
贮存方式
|
|
裂解液RSL
|
30
ml
|
常温
|
|
缓冲液PRS
|
3
ml
|
常温
|
|
裂解液RL
plus
|
30
ml
|
常温
|
|
去蛋白液RD
|
30
ml
|
常温
|
|
漂洗液RW(浓缩液)
|
25
ml
首次使用按照标签加入无水乙醇
|
常温
|
|
RNase-free水
|
5
ml
|
4℃
|
|
DNA清除柱CS(RNase-free)
|
50个
|
常温
|
|
RNA吸附柱CR(RNase-free)
|
50个
|
常温
|
|
收集管
|
100个
|
常温
|
|
2
ml离心管(RNase-free)
|
50个
|
常温
|
|
1.5
ml离心管(RNase-free)
|
150个
|
常温
|
|
说明书
|
1份
|
|
● 储存条件和效期:
RNase-free水4℃保存;其他试剂在常温(25℃左右)干燥条件下,可保存1年。试剂盒常温运输。
● 产品简介:
本试剂盒可从植物种子中快速提取总RNA,通过独特的裂解系统,快速去除植物组织中的淀粉、多糖等成分,释放
RNA。试剂盒配套缓冲液PRS(Phenolic Remove Solution)可以去除种子中的多糖多酚对RNA提取的影响。另外,试剂盒配套DNA清除柱,可以消除基因组DNA的污染。整个提取过程仅需20-30分钟内即可完成,可以从50
mg植物种子中提取数十微克高纯度RNA,基本没有DNA和蛋白的污染,可用于Northern
blot、Dot blot、polyA
筛选、体外翻译、RNase 保护分析和分子克隆等实验。
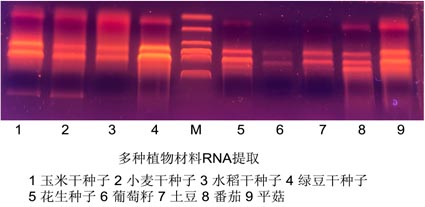
已经测试的植物种子有:拟南芥干种子、小麦干种子、水稻干种子、芝麻种子、玉米干种子、豌豆种子、红豆干种子、绿豆干种子、向日葵种子、西瓜种子、油莎豆、花生、大豆等。另外,该试剂盒也适合于提取块茎、鳞茎的RNA。
植物RNA提取介绍:
由于植物种类繁多,不同的植物种类和部位的样品使用本试剂盒效果不同。我们已经测试成功的植物列表如下:
|
植物样品种类
|
提取植物材料
|
是否添加缓冲液PRS
|
推荐裂解液
|
RNA质量度
|
RNA得量
|
|
A260/280
|
A260/230
|
|
简单植物叶片、幼苗、茎
|
玉米叶片
|
-
|
裂解液RL
|
|
|
30-40 μg/100 mg
|
|
小麦叶片
|
-
|
裂解液RL
|
|
|
40-50 μg/100 mg
|
|
水稻叶片
|
-
|
裂解液RL
|
|
|
45-55 μg/100 mg
|
|
拟南芥叶片
|
-
|
裂解液RL
|
|
|
10-15 μg/100 mg
|
|
烟草叶片
|
-
|
裂解液RL
|
|
|
40-55 μg/100 mg
|
|
绿萝叶片
|
-
|
裂解液RL
|
1.87
|
2.21
|
5-10 μg/100 mg
|
|
多糖多酚植物叶片
|
银杏叶片
|
+
|
裂解液RL
|
|
|
10-15 μg/50 mg
|
|
松针
|
+
|
裂解液RL
|
|
|
10-15 μg/50 mg
|
|
毛白杨叶片
|
+
|
裂解液RL
|
|
|
20-30 μg/50 mg
|
|
冬青叶片
|
+
|
裂解液RL
|
|
|
1-5 μg/50 mg
|
|
法国梧桐样品
|
+
|
裂解液RL
|
2.14
|
1.97
|
10-20 μg/50 mg
|
|
种子
|
黄豆种子
|
+
|
裂解液RSL
|
|
|
40-50 μg/50 mg
|
|
花生种子
|
+
|
裂解液RSL
|
|
|
20-25 μg/50 mg
|
|
玉米种子
|
+/-
|
裂解液RSL
|
2.00
|
2.37
|
20-40 μg/50 mg
|
|
水稻种子
|
+
|
裂解液RSL
|
|
|
5-10 μg/50 mg
|
|
小麦种子
|
+/-
|
裂解液RSL
|
2.03
|
2.28
|
10-15 μg/50 mg
|
|
高粱种子
|
+
|
裂解液RSL
|
|
|
5-10 μg/50 mg
|
|
绿豆种子
|
+
|
裂解液RSL
|
|
|
5-10 μg/50 mg
|
|
油莎豆
|
+
|
裂解液RSL
|
2.26
|
2.17
|
7-15 μg/50mg
|
|
拟南芥种子
|
+
|
裂解液RSL
|
2.17
|
1.98
|
3-5μg/50mg
|
|
南瓜籽
|
+
|
裂解液RSL
|
2.27
|
1.68
|
10-15μg/50mg
|
|
水果果肉
|
芒果
|
+
|
裂解液RL
|
|
|
1-2 μg/50 mg
|
|
西红柿
|
+
|
裂解液RL
|
|
|
2-3 μg/50 mg
|
|
苹果
|
+
|
裂解液RL
|
|
|
3-5 μg/50 mg
|
|
西瓜
|
+
|
裂解液RL
|
|
|
1-2μg/50 mg
|
|
香蕉
|
+
|
裂解液RL
|
|
|
2-3 μg/50 mg
|
|
梨
|
+
|
裂解液RL
|
|
|
3-5 μg/50 mg
|
|
真菌材料
|
香菇菌丝体
|
-
|
裂解液RL/RSL
|
|
|
2-3 μg/100 mg
|
|
平菇菌丝体
|
-
|
裂解液RL
|
|
|
2-3 μg/100 mg
|
|
块茎
|
马铃薯
|
+/-
|
裂解液RSL
|
|
|
10-15 μg/50 mg
|
|
紫薯
|
+/-
|
裂解液RSL
|
2.35
|
1.91
|
2-5 μg/50 mg
|
注:+ 表示添加,-表示不添加, +/- 表示添加不添加均可, NA表示无数据
● 准备工作:
1操作前在裂解液RSL中加入β-巯基乙醇至终浓度5%,如500
μl RSL中加入25
μl β-巯基乙醇。此裂解液最好现用现配。配好的
RSL4 ℃可放置3天。
2
按照标签所示在漂洗液RW中加入无水乙醇(自备),混匀后盖紧瓶盖后常温贮存备用。
3
准备65℃水浴
4
所有离心步骤均在常温下进行。
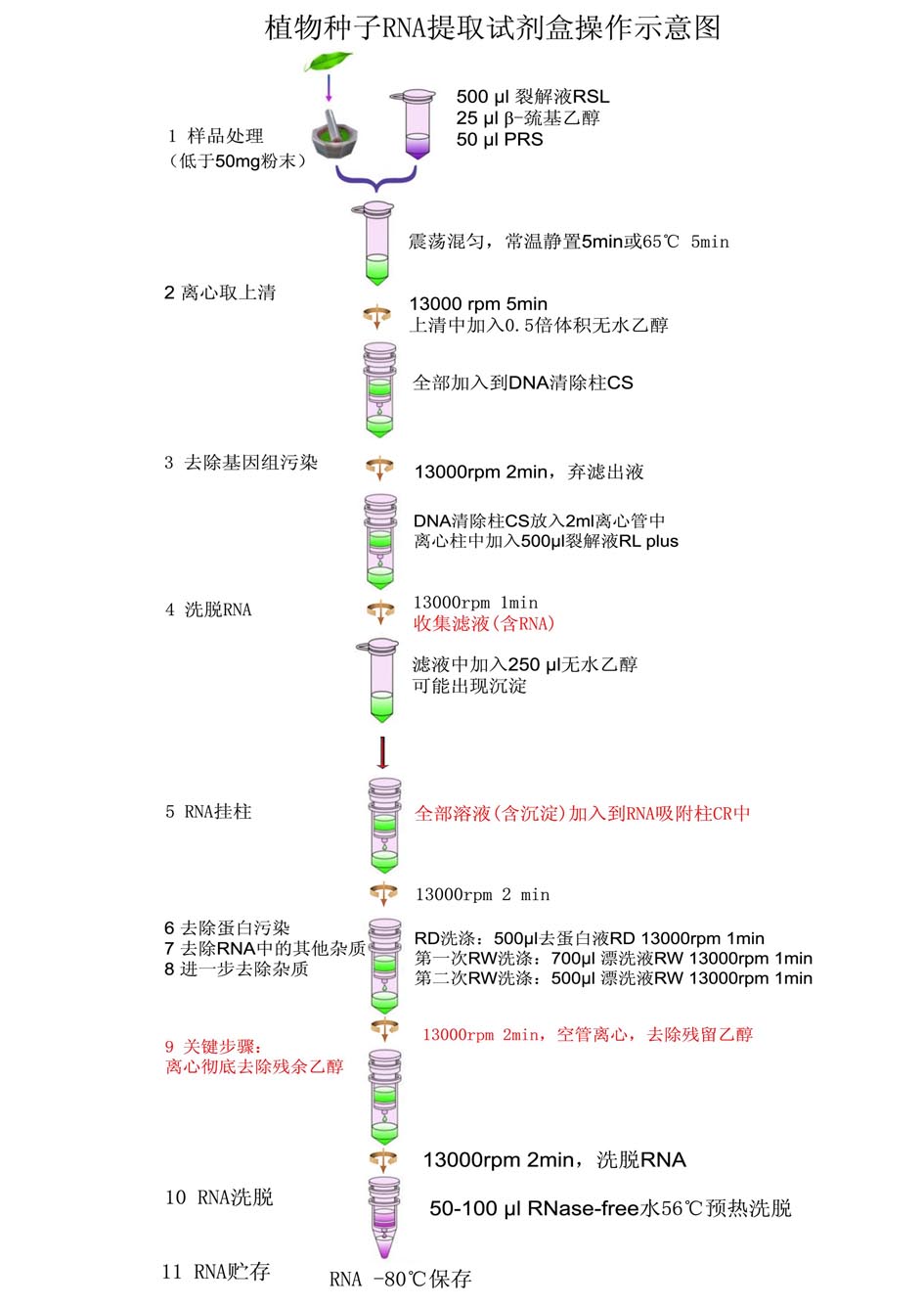
● 操作步骤:
1. 样品处理:
1.1 1.5 ml RNase-free离心管中加入500 μl裂解液RSL(使用前请先检查是否已加入β-巯基乙醇),50
μl缓冲液PRS混匀备用。
注:缓冲液PRS有助于去除样品中的多糖和多酚,禾本科植物如水稻,小麦和玉米的种子RNA提取中可以不用添加;如不能判断材料是否含多糖和多酚,请加入缓冲液PRS。
1.2将种子加入到液氮预冷的研钵中,用研杵研磨,其间不断加入液氮,直至研磨成粉末状。取20-50 mg粉末迅速加入到离心管中,涡旋剧烈震荡混匀,65℃水浴放置5分钟,间歇混匀。
注:一定不要加入超过50 mg的粉末,否则样品超过裂解液RSL的裂解能力导致RNA提取失败。
2. 离心取上清:
13,000 rpm离心5
min,小心吸取收集管中的上清至1.5 ml RNase-free的离心管中,吸头尽量避免接触收集管中的细胞碎片沉淀。一般可获得400 μl上清。
注:一些种子富含油脂如花生种子,离心后脂肪位于最上层,用吸头穿越脂肪层吸取上清;禾本科植物如水稻,小麦,玉米,高粱种子会有大量沉淀生产。
3. 去除基因组污染:
上清中加0.5倍体积的无水乙醇(如400 μl上清中加入200 μl无水乙醇),混匀(此时可能会出现沉淀),得到的溶液和沉淀一起转入DNA清除柱CS(清除柱放入收集管中)中,13,000 rpm离心2分钟,弃掉收集管中的废液。
注:吸附柱的最大容积是850 μl,超过此体积分步上柱,确保全部溶液都通过过滤柱,如果膜上有残留液体,延长离心时间至5分钟,保证膜上无残留液体。
4. 洗脱RNA:
将DNA清除柱放入2 m l RNase-free离心管中,在清除柱中加入500
μl 裂解液RL plus,13,000 rpm离心1分钟,收集滤液(注意:RNA在滤液中,不要丢弃),滤液中加入250 μl无水乙醇,此时可能会出现沉淀,立即混匀,不要离心。
5. RNA挂柱:
将全部溶液加入到RNA吸附柱CR中(吸附柱放入收集管中),13,000 rpm离心2分钟,弃废液。
注:确保溶液全部过滤到收集管中,膜上无残留,如有必要,可以延长离心时间至5分钟。
6. 去除RNA中的蛋白污染:
向RNA吸附柱CR中(吸附柱放入收集管中)加入500 μl 去蛋白液RD,13,000
rpm离心1分钟,弃废液。
7. 去除RNA中的其他杂质:
向RNA吸附柱CR中加入700
μl漂洗液RW(使用前请先检查是否已加入乙醇), 13,000 rpm离心1分钟,弃废液。
8. 进一步去除RNA中的其他杂质:
向吸附柱CR中加入500
μl漂洗液RW (使用前请先检查是否已加入乙醇),13,000 rpm离心1
分钟,弃废液。
9. 关键步骤:彻底去除吸附柱上的残余乙醇:
将吸附柱CR放回收集管中,确保盖好吸附柱管盖,13,000 rpm将吸附柱CR空甩离心2 分钟,去除吸附柱上的残余液体。
注:此步骤目的是将吸附柱中残余的漂洗液去除,如果有漂洗液残留,可能会影响后续的RT等实验操作。
10. 洗脱得到RNA:
将RNA吸附柱CR转入一个新的1.5 ml RNase-free离心管中,向吸附柱O型垫圈中央悬空加入50-100 μl RNase-free水(事先65℃预热可提高洗脱效率),盖好吸附柱管盖,常温放置2分钟,13,000
rpm离心2 分钟。
注:确保水要加到膜的中央,不要贴壁加入;洗脱缓冲液体积不应少于50
μl,体积过小影响回收效率。
11. RNA贮存:
RNA样品-80℃中保存。
● RNA产量和质量的评估:
1.
RNA产量:
用分光光度计测定OD260的吸光值来计算RNA产量。将RNA按照一定的比例稀释于TE溶液(10mMTris pH8.0,1mMEDTA)中,根据以下公式计算:
A260×稀释倍数×40=μg
RNA/ml
注:测定OD值时,尽量不要用RNase-free水稀释RNA,因为RNase-free水pH较低,测定的OD值偏低。
2.
RNA质量:
凝胶电泳检测:凝胶电泳中,完整的RNA应该有两条主带:28S和18S,并且28S亮度应该与18S相当或是其亮度的2倍。可以使用普通的1×TAE琼脂糖凝胶电泳,凝胶浓度1.5
%,可以使用高电压,短时间电泳,如7V/cm电泳,20分钟。建议使用D2000
DNA ladder(Cat:RTM415)作为Marker。植物28S rRNA迁移率与1500 bp类似,18S rRNA迁移率与1000bp类似。
吸光值检测:可以用A230,A260和A280的数值表示RNA的纯度。纯净的RNA的
A260/A280比值应该为2,我们得到的RNA样品比值应在1.8-2.2之间,如果比值低于1.8,表明RNA样品中蛋白污染比较严重。
A260/A230比值应该在2-2.2之间。如果此比值低于2,表明RNA样品中有胍盐,多糖的污染。
实验示例:

RTR2308 RealPure植物种子RNA提取试剂盒发表文章列表:
1. [2022
IF=6.5] Metabolic pathways modulated by coumarin to inhibit seed
germination and early seedling growth in Eleusine
indica.
植物:牛筋草
Author: Tai-Jie Zhang, Zhao Ma, Hong-Ju Ma, Xing-Shan Tian, Wen-Lei Guo,
Chun Zhang.
Journal: Plant Physiology and Biochemistry 203 (2023) 108035
Institution: Institute of Plant Protection, Guangdong Academy of
Agricultural Sciences
Paper
link:https://www.sciencedirect.com/science/article/pii/S0981942823005466