植物叶绿体DNA提取试剂盒
|
产品编号
|
产品名称
|
包装
|
|
RTU5003
|
植物叶绿体DNA提取试剂盒
|
50次
|
● 产品简介:
叶绿体(Chloroplast)是质体的一种, 是高等植物和一些藻类所特有的能量转换器,是光合作用的反应场所。在高等植物中叶绿体为双凸或平凸透镜,长径5~10μm,短径2~4μm,厚2~3μm。高等植物的叶肉细胞一般含50~200个叶绿体,可占细胞质的40%,叶绿体的数目因物种细胞类型,生态环境,生理状态而有所不同。叶绿体由叶绿体外被(chloroplast envelope)、类囊体(thylakoid)和基质(stroma)三部分组成,含有3种不同的膜:外膜、内膜、类囊体膜和3种彼此分开的腔:膜间隙、基质和类囊体腔。
叶绿体DNA(Chloroplast
DNA,cpDNA),存在于叶绿体内,高等植物叶绿体的DNA为双链共价闭合环状分子,其长度随生物种类而不同,其大小在120 kb到217 kb之间,相当于噬菌体基因组的大小双链环状,一个叶绿体含有10~50个cpDNA。
本试剂盒是结合植物叶绿体纯化试剂盒和离心柱式植物DNA提取试剂盒而推出的新产品,专门用于植物叶绿体DNA的快速提取。
1.
纯度高,不含污染和抑制剂,可以直接用于酶切、PCR、real-time
PCR、
multiplex PCR、RAPD、RFLP、AFLP、Southern
Blotting, microsatellite analysis等各种后续分子生物学实验。
2.
以每次处理30
g叶片计算,本产品可使用8-10次提取植物叶绿体,每次能得到3-5
mg左右叶绿体。按照每次使用0.2
ml 叶绿体溶液计算,可以至少提取50次叶绿体DNA的纯化。cpDNA
产率一般在1-2
μg/1 g叶片样品。OD260/280一般在1.8以上。DNA片段长度一般在40-50
Kb左右。
3.
已经成功用于菠菜,大豆,莴笋,白菜,烟草和甜菜等双子叶植物,也适用于单子叶等其他植物(可能需要优化条件)。
● 贮存及运输:
4-8℃保存,至少一年有效;试剂盒常温运输。
● 产品组成:
|
产品货号
|
产品名称
|
包装
|
贮存
|
|
RTU5003-01
|
叶绿体提取缓冲液(5×)
|
2×250
ml
|
4-8℃
|
|
RTU5003-02
|
密度梯度分离试剂
|
65
ml
|
4-8℃
|
|
RTU5003-03
|
BSA
|
3
g
|
4-8℃
|
|
RTU5003-04
|
1
M DTT(粉末装)
|
2.5
ml
|
4-8℃
配制后-20℃贮存
|
|
RTU5003-05
|
过滤纸
|
50张/包
|
RT
|
|
RTU5003-06
|
叶绿体DNA提取缓冲液AP1
|
25
ml
|
RT
|
|
RTU5003-07
|
叶绿体DNA提取缓冲液AP2
|
10
ml
|
RT
|
|
RTU5003-08
|
叶绿体DNA提取缓冲液AP3(浓缩液)
|
15
ml
|
RT
|
|
PW-25ml
|
漂洗液PW(浓缩液)
|
25
ml
|
RT
|
|
RNaseA-0.5ml
|
RNase A(10 mg/ml)
|
0.5
ml
|
-20℃
|
|
EB-15ml
|
洗脱缓冲液EB
|
15
ml
|
RT
|
|
CG-50
|
吸附柱CG(白色)
|
50个/包
|
RT
|
|
CT-50
|
收集管
|
50个/包
|
RT
|
|
|
说明书
|
一份
|
-
|
● 使用说明:
一 植物叶绿体提取:
注意:叶绿体对温度高度敏感,所以整个操作必须在冰上或者在冷室进行,所用器皿和溶液均需要在4℃预冷。叶绿体提取过程中离心时一定要在4℃进行,离心力以g而不是rpm计算。如果需要研究叶绿体的功能,提取过程还需要在昏暗的光线条件下进行。
需要自备材料:
剪刀;50
ml尖底或圆底离心管;15
ml尖底或圆底离心管;漏斗;匀浆机;低温离心机。
1.1 材料预处理:
实验前1-2天将植物放在暗室培养以减少叶绿体中淀粉颗粒的形成,否则离心时这些颗粒很容易使叶绿体破裂。叶片在实验前需先用自来水洗净,再用蒸馏水淋洗,去掉多余水分。如果叶片采集后不能立即处理,则保存时需要保持叶片湿润,即使如此,叶片采集后的放置时间也不能超过一天。
1.2
1×叶绿体提取缓冲液(即用型)配制:
|
|
1×叶绿体提取缓冲液(即用型)
配制量200 ml
|
|
叶绿体提取缓冲液(5×)
|
40 ml
|
|
BSA
|
0.2 g
|
|
1 M DTT
|
200 μl
|
|
灭菌水
|
定容至200 ml
|
|
|
冰上预冷待用,现用现配,不建议贮存
|
注:一个30克样品提取反应需要 150 ml 1×叶绿体提取缓冲液(即用型)。
1.3 叶片匀浆:
1.3.1 新鲜采集植物叶片,快速去除叶脉(约30克)并将叶片剪成1-3 cm2大小的碎片并浸泡在150 ml的预冷的1×叶绿体提取缓冲液(即用型)中(每克叶片加5 ml)。
1.3.2 将浸泡了叶片的溶液转移到匀浆机(货号:RT-2243A)中,低速匀浆10秒,避免起泡沫。用玻璃棒把液面的碎片按入匀浆机底部后,再低速匀浆10秒,重复10秒匀浆3-4次至叶片破碎即可,不要过分匀浆,否则会降低完整叶绿体的得率。
1.3.3 用2层过滤纸置于小漏斗上,将匀浆液过滤收集到预冷的250 ml量筒中,一般更换三次滤纸可收集约120 ml滤液,将滤液等分到4个预冷的50 ml的塑料离心管中(每个管中的滤液不要超过35 ml)。
1.4 离心去杂质:
4℃ 200 g离心5分钟,保留上清,沉淀为未破裂植物组织、细胞或细胞核(下图);如果样品中淀粉含量较高,沉淀可能为白色。
注:此步骤用低速离心去除杂质,不能省略,否则得到的叶绿体DNA中会有核基因组的污染。

1.5 收集叶绿体粗提液:
1.5.1将步骤1.4得到的上清液平分到4个预冷的50 ml塑料离心管中;4℃ 1100 g离心15分钟,小心弃上清,沉淀含叶绿体,呈深绿色(下图)。

1.5.2 在沉淀中加入1.5 ml 预冷的1×叶绿体提取缓冲液(即用型),手弹离心管底部使叶绿体重悬,收集4管溶液(约6 ml),此溶液即为叶绿体粗提产物。
1.5.3 如果对叶绿体DNA是否含细胞核DNA的要求不高,则叶绿体粗提液可以直接用于叶绿体DNA纯化(步骤2.1)。
1.6 完整叶绿体的纯化:
叶绿体重悬液配制
|
|
叶绿体重悬液
|
|
|
配制量20 ml
|
|
叶绿体提取缓冲液(5×)
|
4 ml
|
|
灭菌水
|
16 ml
|
|
|
冰上预冷待用,现用现配,不建议贮存
|
1.6.1 单梯度分离法(适合菠菜,白菜,莴苣,拟南芥,绿萝等):
1.6.1.1 40%密度梯度液配制-10 ml:
在15 ml离心管中加入6 ml 1×叶绿体提取缓冲液(即用型)和4 ml密度梯度分离试剂,充分混合均匀,得40%密度梯度液,冰浴备用。
1.6.1.2将10 ml 40%密度梯度液平分到2个 15 ml离心管中,每管5 ml;将步骤1.5.2得到的叶绿体粗提液3 ml小心铺在5 ml密度梯度液之上;另一管重复。(5 ml 40%密度梯度液用可以分离3 ml 叶绿体粗提液,其他体积以此比例换算)。
1.6.1.3 4℃ 3200 g离心30分钟,绿色沉淀为完整叶绿体(下图)。
注:如果最上层的分离试剂不够清亮,可以延长离心20分钟。

1.6.1.4 小心弃上清,保留沉淀,每管沉淀中加入1 ml 叶绿体重悬液,轻柔重悬,可以收集到2 ml完整叶绿体溶液。
1.6.1.5 此叶绿体溶液可以提取得到无细胞核DNA污染的叶绿体DNA
(步骤2.1)。
1.6.2双梯度分离法(适合烟草,甜菜,豌豆等):
1.6.2.1 80%密度梯度重液配制-4 ml:
在15 ml离心管中加入0.8 ml 1×叶绿体提取缓冲液(即用型)和3.2 ml 密度梯度分离试剂,充分混合均匀,得80%密度梯度重液。
1.6.2.2 40%密度梯度轻液配制-8 ml:
在另一15 ml离心管加入4.8 ml 1×叶绿体提取缓冲液(即用型)和3.2 ml 密度梯度分离试剂,充分混合均匀,得40%密度梯度轻液。
1.6.2.3 取一只15 ml离心管,加入1.86 ml 80%密度梯度重液,随后取3.74 ml 40%密度梯度轻液小心铺在80%密度梯度重液之上,冰浴备用;然后取步骤1.5.2得到的3 ml叶绿体粗提液小心铺在密度梯度轻液之上。另一管重复。
注:每5.6 ml
40%/80%密度梯度液可以分离3 ml 叶绿体粗提液;其他体积按照比例调整。
1.6.2.4 4℃ 3200 g离心30分钟,上层绿色带含破碎的叶绿体、线粒体和核糖体等,重液和轻液间的绿色带为完整叶绿体(下图)。
注:如果最上层的分离试剂不够清亮,可以延长离心20分钟。
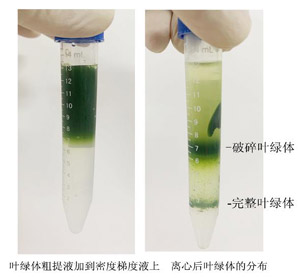
1.6.2.5 重悬叶绿体:
用广口吸管小心将重液和轻液之间的绿色带(完整叶绿体)转 移到新的15 ml离心管中,加入三倍体积预冷的叶绿体重悬液,轻柔混匀。
1.6.2.6 离心收集叶绿体:
4℃ 1750 g离心6分钟,小心将上清倒出后,在绿色的叶绿体沉淀中加入预冷的1 ml叶绿体重悬液,手指轻弹管底使叶绿体重悬。最终可以收集到2
ml完整叶绿体溶液。
1.6.2.7此叶绿体溶液可以提取得到无细胞核DNA污染的叶绿体DNA(步骤2.1)。
1.7 叶绿体贮存:
叶绿体可在显微镜下检查叶绿体完整性。叶绿体重悬液避光-80℃保存。叶绿体必须尽快使用,否则非常容易失去活性。
1.8 叶绿素含量测定:
通常叶绿体含量用单位叶绿素含量来表示,即x
mg 叶绿素/ml 叶绿体悬浮液。
1.8.1
取10 μl 叶绿体悬浮液加入到990
μl 80%丙酮溶液中,混匀。
1.8.2
3000 g 离心5分钟,取上清测定OD652 吸光值,用80%丙酮做空白对照。
1.8.3
根据以下公式计算叶绿素:
叶绿素浓度(mg/ml)=(OD652×100)/36
100:稀释倍数
36:extinction
coefficient in ml/cm·mg
二 叶绿体DNA提取:
注:以下离心操作可以常温下进行。
2.1
取0.2-0.4 ml叶绿体溶液,3500 g离心2分钟,小心弃上清,沉淀为叶绿体。
注:可以根据提取的叶绿体浓度大体估算提取到的cpDNA浓度。经验值:每50
μg 叶绿体(叶绿素浓度)可以提取到1μg
cpDNA。
2.2叶绿体沉淀中加入400 μl 缓冲液AP1和6 μl RNaseA (10mg/ml),漩涡震荡1分钟。
2.3
将离心管放在65℃水浴10分钟,水浴过程中颠倒离心管以混合样品数次。
2.4
加入130 μl 缓冲液AP2,颠倒混匀,冰浴5分钟。
2.5 12,000 rpm离心5分钟,保留上清,上清通常为无色,沉淀为绿色。注:此步骤离心去除去垢剂,蛋白以及多糖等杂质。
2.6 将上清(通常可取到400 μl)转移到1.5 ml离心管中,加入1.5倍体积(例如400 μl的上清液加600 μl)缓冲液AP3(使用前请注意是否已经加入无水乙醇),立即颠倒混匀,简短离心以去除管盖内壁的水珠。
2.7吸取步骤2.6中的混合液加入到吸附柱CG中(吸附柱放入收集管中),12,000 rpm离心1分钟,倒掉废液,吸附柱CG放回收集管中。
注:离心吸附柱的最大容积是700 μl,如果一次不能完全上柱,可以分次上柱离心,保证全部溶液全部加到离心柱中。
2.8向吸附柱CG中加入700
μl漂洗液PW(使用前请先检查是否已加入无水乙醇),12,000 rpm离心1分钟,倒掉废液,吸附柱CG放入收集管中。
2.9向吸附柱CG中加入500
μl漂洗液PW(使用前请先检查是否已加入无水乙醇),12,000 rpm离心1分钟,倒掉废液,吸附柱CG放入收集管中。
2.10将吸附柱CG放回废液收集管中,12,000 rpm离心2分钟。
注:此步骤非常重要,目的是将吸附柱中残余的漂洗液去除。漂洗液中乙醇的残留会影响后续的酶反应(酶切、PCR等)实验。
2.11将吸附柱CG转入一个干净的1.5ml离心管中,向吸附膜的中间部位悬空滴加50-100
μl经65℃水浴预热的洗脱缓冲液EB,室温放置2分钟,12,000
rpm g离心2分钟。
注:洗脱缓冲液体积不要少于50 μl,体积过小影响回收效率;洗脱液的pH值对于洗脱效率有很大影响。若用水做洗脱液应保证其pH值在7.0-8.5范围内,pH值低于7.0会降低洗脱效率。
2.12 叶绿体DNA产物-20℃保存。
三 实验示例:
3.1 叶绿体提取示例:
30克绿萝叶片,加入150
ml 1×叶绿体提取缓冲液(即用型) 匀浆5×10秒,3次过滤共收集120
ml过滤液,平分4管,4℃ 1100
g 离心15 min,弃上清,每管重悬于1.5
ml 1×叶绿体提取缓冲液(即用型)中,共得到6
ml 叶绿体粗提液。2×3
ml 粗提液平铺于2×5
ml 40%密度梯度液之上,4℃ 3200 g离心15分钟,弃上清,每管沉淀重悬于1 ml 叶绿体重悬液中,共得到2 ml精制叶绿体重悬液,测定叶绿素含量为3.43 mg/ml重悬液。30克叶片提取得到6.86 mg叶绿体。取10
μl叶绿体溶液稀释20倍,取50 μl稀释液显微镜40倍物镜观察,如下图。

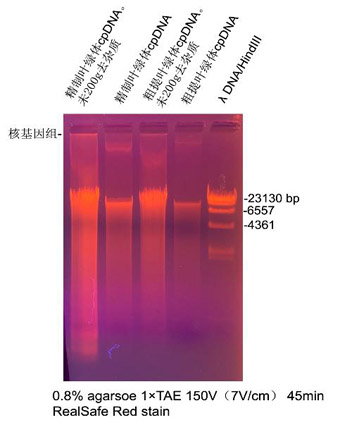
3.2 叶绿体DNA电泳示例:
叶绿体提取同3.1。取100 μl叶绿体重悬液,提取cpDNA,最后用50
μl洗脱,上样5 μl,电泳结果见下图左二泳道,cpDAN大小约20kb,无可见核基因组污染。