Western及IP细胞裂解液
● 产品包装:
|
产品编号
|
产品名称
|
产品包装
|
说明书
|
|
WL0120
|
Western及IP细胞裂解液
|
100 ml
|
1份
|
● 产品简介:
Western及IP细胞裂解液(Cell lysis buffer for Western and IP),是一种在非变性条件下裂解细胞的裂解液。本细胞裂解液裂解的细胞,可以用于PAGE,Western,免疫沉淀(immunol precipitation,IP)和免疫共沉淀(Co-IP)。裂解液的主要成分为20 mM
Tris (pH7.5),150 mM NaCl,1% Triton X-100等,裂解后能维持原有的蛋白间相互作用。由于含有较高浓度的Triton X-100等干扰物质,不能用传统Bradford法测定由本裂解液裂解得到样品的蛋白浓度,可以使用BCA蛋白浓度测定试剂盒(货号:RTP7102)或Bradford蛋白浓度测定试剂盒(去垢剂兼容型)(货号:RTP7104)测定蛋白浓度。
● 保存条件:
-20℃保存,一年有效。
● 注意事项:
1.为取得最佳的使用效果,尽量避免过多的反复冻融。可以适当分装后使用。
2. 需自备PMSF或其他蛋白酶抑制剂;如进行蛋白磷酸化研究,还需要自备磷酸酶抑制剂。
3. 裂解样品的所有步骤都需在冰上或4℃进行。
● 使用说明:
1. 准备裂解液:
溶解裂解液,混匀;取适当量的裂解液,在使用前数分钟内加入1/100体积的100 mM PMSF,使PMSF的最终浓度为1 mM。如进行蛋白磷酸化研究,需要加入磷酸酶抑制剂。
2. 细胞蛋白提取:
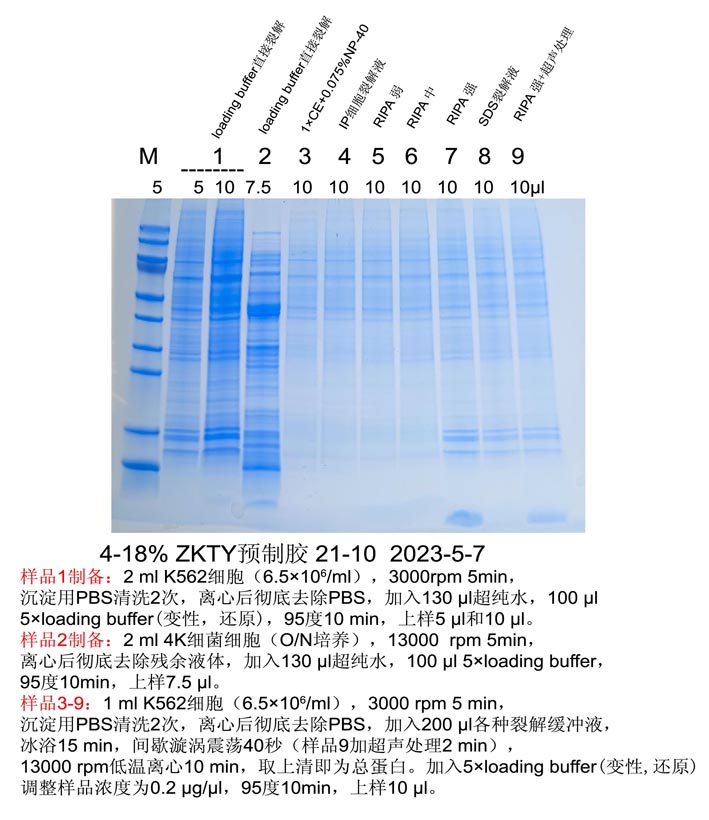
2.1 贴壁细胞:去除培养液,加入适量1×PBS,轻柔漂洗一遍,不要扰动贴壁细胞。按照6孔板每孔加入100-200 μl裂解液的比例加入裂解液,移液器吹打数下,使裂解液和细胞充分接触,冰上裂解细胞5分钟,用细胞刮刀刮下细胞收集于1.5 ml离心管中,冰上继续裂解15分钟,间歇混匀。
|
培养板规格/培养皿表面积
|
细胞量
|
裂解液推荐使用量
|
|
100 mm培养皿
|
1.5×107
|
0.5-1 ml
|
|
60 mm培养皿
|
5×106
|
0.25-0.5 ml
|
|
35 mm培养皿
|
2×106
|
0.2-0.4 ml
|
|
6孔板
|
2.5×106
|
100-200 μl
|
|
24孔板
|
5×105
|
100-150 μl
|
|
96孔板
|
1×105
|
50-100 μl
|
2.2 悬浮细胞:450 g
4℃ 离心5 min收集细胞;用适量1×PBS重悬细胞,450 g 4℃ 离心5 min收集细胞;重复漂洗细胞一次;按照细胞沉淀体积(PCV)20 μl加入200 μl 裂解液,混匀细胞沉淀,冰浴处理15分钟,间歇混匀。
注:2×106 Jurkat细胞,其细胞沉淀体积(PCV,Packed Cell Volume)大约为20 μl。
2.3 裂解细胞:
用玻璃匀浆器匀浆,直至充分裂解或通过强烈涡旋震荡使样品裂解充分。冰浴处理15分钟。
注:裂解混合物不建议使用超声波破碎仪处理,因为超声波处理比较剧烈,容易破坏蛋白的相互作用导致蛋白变性。
2.4 离心收集上清:
充分裂解后,4℃ 16000
g离心10分钟,取上清,即可进行后续的PAGE、Western和免疫沉淀等操作。
3. 组织样品蛋白提取:
3.1 手术切除的组织块迅速置于预冷的生理盐水中,漂洗数次,洗净组织血迹,用滤纸吸干组织表面液体,将组织切成细小的碎片。
3.2 按照每20 mg组织加入200 μl裂解液的比例加入裂解液。(如果裂解不充分可以适当添加更多的裂解液,如果需要高浓度的蛋白样品,可以适当减少裂解液的用量。)
3.3 用玻璃匀浆器冰浴匀浆5-10次,收集匀浆后的裂解混合物。裂解物冰浴处理15分钟。
注:裂解混合物不建议使用超声波破碎仪处理,因为超声波处理比较剧烈,容易破坏蛋白的相互作用导致蛋白变性。
3.4 充分裂解后,4℃ 16000
g离心10分钟,取上清,即可进行后续的PAGE、Western和免疫沉淀等操作。
实验示例: